2431 0
سرطان خون میلوئیدی مزمن (CML)یک بیماری کلونال نئوپلاستیک یک سلول بنیادی خونساز با قدرت درگیر غالب از سلول سلول گرانولوسیتی است.
این بیماری اولین بار توسط R. Virkhov در اواسط قرن 19 با نام "سرطان خون طحال" توصیف شد. CML تقریباً 20٪ از سرطان خون در اروپا را تشکیل می دهد.
بیشتر اوقات ، افراد میانسال و مسن با سن متوسط \u200b\u200bحدود 50 سال بیمار می شوند ، اگرچه CML در هر سنی ممکن است ایجاد شود.
در بروز جنسیت و قومیت وابستگی وجود ندارد.
علت CML ناشناخته است. در میان بازماندگان بمب گذاری های اتمی در ژاپن ، افزایش شیوع CML پس از یک دوره تأخیر سه ساله ، با اوج در 7 سال مشاهده شد. در گروهی از بیماران در انگلیس که تحت پرتودرمانی برای اسپوندیلیت آنکیلوزان قرار گرفتند ، پس از یک دوره تأخیر 13 ساله ، میزان بروز لوسمی میلوئید مزمن افزایش یافت.
به طور کلی ، کمتر از 5٪ بیماران CML سابقه قرار گرفتن در معرض اشعه یونیزان داشته اند. تماس با عوامل میلوتوکسیک در موارد جدا شده مشخص شده است. اگرچه در فراوانی بیان آنتی ژن های HLA-Cw3 \u200b\u200bو HLA-Cw4 در CML افزایش یافته است ، اما گزارشی از CML خانوادگی گزارش نشده است. بروز CML در هر 100000 نفر جمعیت 1.5 است.
در سال 1960 ، G.Nowell و D.Hungerford در بیماران CML کوتاه شدن بازوی بلند یک کروموزوم (Xp) را کشف کردند ، همانطور که آنها معتقد بودند ، از جفت 21 است. این کروموزوم توسط آنها Philadelphia یا Ph-chromosome نامگذاری شد.
با این حال ، در سال 1970 T. Caspersson و همکاران دریافت که در لوسمی میلوئیدی مزمن ، یکی از 22 جفت Chr وجود دارد. در سال 1973 ، جی رولی نشان داد که تشکیل کروموزوم Ph به دلیل انتقال متقابل (انتقال متقابل بخشی از ماده ژنتیکی) بین Xp9 و Xp22 است. این کروموزوم تغییر یافته از جفت 22 با بازوی بلند کوتاه شده به عنوان کروموزوم Ph شناخته می شود.
در دوره اولیه مطالعه سیتوژنتیک CML ، دو نوع - Ph + و Ph- توصیف شده است. با این حال ، اکنون باید تشخیص داده شود که Ph-CML وجود ندارد و موارد توصیف شده احتمالاً مربوط به شرایط myelodysplastic بود. کروموزوم Ph ، t (9؛ 22) (q34؛ q11) در 95-100٪ بیماران CML دیده می شود.
در موارد دیگر ، گزینه های زیر برای انتقال امکان پذیر است:
انتقال پیچیده شامل Chp9 ، 22 و هر کروموزوم سوم ،
- جابجایی های نقاب دار با همان تغییرات مولکولی ، اما با روش های معمول سیتوژنتیک تعیین نشده است ،
- وجود t (9؛ 22) بدون انتقال بخش Xp22 به Xp9.
بنابراین ، در همه موارد CML ، تغییراتی در Xp9 و Xp22 با بازآرایی ژن مشابه در یک منطقه خاص از Xp22 وجود دارد (2).
روی بازوی بلند Xp9 (q34) پروتئونکوژن ABL (Abelson) قرار دارد که از طریق سنتز mRNA خاص تشکیل پروتئین p145 متعلق به خانواده را کد می کند. تیروزین کیناز (TC) - آنزیم هایی که فرآیندهای فسفوریلاسیون اسیدهای آمینه را در چرخه سلولی کاتالیز می کنند. روی بازوی بلند Xp22 (q 11) M-BCR (منطقه خوشه مهمترین نقطه شکست) قرار دارد.
از ژن واقع شده در این منطقه به عنوان ژن BCR یاد می شود. این کد کننده تولید پروتئین p160BCR است که در تنظیم چندین عملکرد نوتروفیل نقش دارد. در نتیجه جابجایی t (9؛ 22) (q34؛ q11) ، پروتئونکوژن c-acr به منطقه bcr Xp22 منتقل می شود.
معمولاً شکست ژن BCR بین اگزون b2 و b3 یا اگزون b3 و b4 اتفاق می افتد و همجوشی اگزون 2 ژن ABL با قسمت باقیمانده ژن BCR روی Xp22 (با اگزون b2 یا b3) رخ می دهد. در نتیجه ، ژن کایمریک BCR-ABL تشکیل می شود ، یک رمزگذاری غیر عادی 8.5 کیلوبایت ریبونوکلئیک اسید (mRNA)، که پروتئین همجوشی p210BCR-ABL را با فعالیت تیروزین کیناز تولید می کند.
گاهی اوقات نقطه شکست ژن BCR در m-BCR (منطقه خوشه محل شکست جزئی) واقع شده است ، در حالی که تولید ژن کایمریک 7.5 کیلوبایت mRNA رمزگذار پروتئین p190BCR-ABL است. این نوع جابجایی با درگیری سلولهای لنفاوی در روند ارتباط دارد و اغلب باعث ایجاد Ph + می شود لوسمی لنفوبلاستی حاد (همه).
به دلیل فعال شدن ژن ABL ، ناشی از همجوشی آن با ژن BCR ، پروتئین p210BCR-ABL دارای فعالیت تیروزین کیناز به طور قابل توجهی برجسته تر از نمونه اولیه آن p145ABL است. MC ها تیروزین را در پروتئین هایی که رشد و تمایز سلول ها از جمله سلولهای خونساز را تنظیم می کنند ، فسفریله می کنند.
جهش تیروزین کینازها با افزایش فعالیت آنها منجر به فسفوریلاسیون تنظیم نشده تیروزین و بر این اساس ، به اختلال در روند رشد و تمایز سلول ها منجر می شود. با این حال ، این تنها و نه مکانیسم اصلی در پاتوژنز علائم CML نیست.
اثر بیولوژیکی ژن chimeric BCR-ABL به اختلالات اصلی زیر در فعالیت حیاتی سلول کاهش می یابد:
افزایش فعالیت میتوژنیک به دلیل افزایش انتقال سیگنال تکثیر با فعال کردن گیرنده های سلول خونساز به دلیل افزایش فسفوریلاسیون. این نه تنها باعث افزایش تکثیر می شود ، صرف نظر از تأثیر تنظیم کننده عوامل رشد ، بلکه تمایز سلولهای پیش ساز را نیز مختل می کند.
اختلال در چسبندگی سلول به استروما ، که منجر به کاهش زمان تعامل بین سلولهای استروما / خونساز می شود. نتیجه این اختلال در توالی طبیعی تکثیر / بلوغ است ، بنابراین ، سلولهای مولد قبل از تمایز طولانی تر در اواخر مرحله تکثیر مولد هستند. این امر منجر به افزایش زمان تکثیر و گردش سلولهای مولد و ظهور کانونهای خون سازی خارج از حفره می شود.
مهار آپوپتوز به دلیل اثر محافظتی پروتئین p210 و فعال شدن ژن MYC که یک مهار کننده آپوپتوز است و همچنین به دلیل بیان بیش از حد ژن BCL-2. در نتیجه ، لکوسیتها در CML بیشتر از سلولهای طبیعی زندگی می کنند. ویژگی بارز پروتئین p210BCR-ABL توانایی فسفوریلاسیون اتوماتیک است که منجر به فعالیت سلول مستقل و استقلال تقریباً کامل آن از مکانیسم های نظارتی خارجی می شود.
ظهور یک ژنوم سلول ناپایدار در ارتباط با کاهش عملکرد ژن ABL ، از آنجا که حذف آن نقش آن را به عنوان سرکوبگر تومور کاهش می دهد. در نتیجه ، تکثیر سلولی متوقف نمی شود. علاوه بر این ، در روند تکثیر ، سایر انکوژن های سلولی فعال می شوند که منجر به افزایش بیشتر تکثیر سلولی می شود.
بنابراین ، افزایش فعالیت پرولیفراتیو ، کاهش حساسیت به آپوپتوز ، اختلال در فرایندهای تمایز ، افزایش توانایی سلول های پیش ساز خون ساز و نابالغ برای خروج از مغز استخوان به خون محیطی از ویژگی های اصلی سلول های لوسمی در سرطان خون میلوئیدی مزمن است.
لوسمی میلوئیدی مزمن: مراحل رشد ، معیارهای گروه های خطر
در توسعه ، CML سه مرحله را طی می کند: فاز مزمن (CP), مرحله شتاب (PA) و فاز بحران انفجار (قبل از میلاد).مرحله مزمن بیماری (CP) در بیشتر موارد تقریباً یا کاملاً بدون علامت است. شکایت از افزایش خستگی ، ضعف ، گاهی سنگینی در اپی گاستریوم. در معاینه ، بزرگ شدن طحال و به ندرت کبد قابل تشخیص است.
تصویر بالینی و خون شناسی ممکن است بدون علامت باشد ، تعداد لکوسیت ها و پلاکت ها ممکن است طبیعی باشد یا کمی افزایش یابد. در فرمول لکوسیت ها ، می توان یک تغییر چپ متوسط \u200b\u200bرا مشاهده کرد - تک متامیلوسیت ها و میلوسیت ها ، گاهی اوقات افزایش اندکی در تعداد بازوفیل ها. بررسی سیتولوژیک تنها کروموزوم Ph را نشان می دهد بدون اینکه تغییرات بیشتری نسبت به سایر کروموزوم ها ایجاد کند.
در مرحله شتاب ، بیماران هنگام انجام کار معمول خود ، احساس ناراحتی در هیپوکندری سمت چپ ، احساس خستگی می کنند. کاهش وزن ، افزایش دوره ای "بی انگیزه" در دمای بدن ، منعکس کننده وجود پرفشار خون است. به عنوان یک قاعده ، افزایش طحال تعیین می شود و در 20-40 of موارد - افزایش کبد.
علامت اصلی انتقال بیماری به FA تغییر در آزمایشات خون است: لکوسیتوز کنترل نشده توسط داروهای سیتواستاتیک با غلبه کمی از اشکال نابالغ لکوسیت ها افزایش می یابد ، تعداد بازوفیل ها افزایش می یابد و کمتر تعداد ائوزینوفیل ها یا مونوسیت ها افزایش می یابد.
تعداد پلاکت ها می تواند با ایجاد عوارض ترومبوتیک در شروع FA افزایش یابد و به دنبال آن ترومبوسیتوپنی با تظاهرات سندرم هموراژیک از نوع لکه بینی پتشیال افزایش یابد. در مغز استخوان ، FA اندکی افزایش در تعداد سلولهای بلاست (معمولاً کمتر از 20٪) و افزایش محتوای پرومیلوسیت ها و میلوسیت ها را نشان می دهد. در یک مطالعه سیتوژنتیک در FA ، علاوه بر وجود یک کروموزوم Ph ، می توان تغییرات اضافی در سایر کروموزوم ها را نیز مشاهده کرد ، که نشان دهنده ظاهر شدن یک کلون سلول بدخیم است.
در مرحله بحران بلاست ، یک ضعف عمومی شدید ظاهر می شود ، به دلیل نفوذ زیر پریوست در سلولهای بلاست ، تب دوره ای ، تعریق و کاهش قابل توجه وزن بدن ، اسسالژی برجسته است. هپاتوسپلنومگالی در حال افزایش است. به عنوان یک قاعده ، یک دیاتز خونریزی دهنده مشخص وجود دارد. تظاهرات خون شناسی با افزایش تعداد سلولهای بلاست در خون محیطی و / یا مغز استخوان بالای 20٪ با تعداد متغیر لکوسیت ها مشخص می شود.
نوع CD غالب ، نوع میلوبلاستیک است - حدود 50٪ از کل موارد. انواع لنفوبلاستیک و تمایز نیافته - هر کدام حدود 25٪ موارد. CD لنفوبلاستیک از نظر ماهیت بسیار بدخیم است که با تغییر در کلونهای بلاست و در نتیجه با مقاومت در برابر درمان همراه است.
گاهی اوقات CD با افزایش شدید تعداد بازوفیل ها در درجه های مختلف بلوغ در خون محیطی و مغز استخوان بدون تعداد زیادی سلول بلاست مشخص می شود. در بعضی موارد ، بازوفیلی با مونوسیتوز جایگزین می شود.
کم خونی نورموکرومیک و ترومبوسیتوپنی با شدت متفاوت ، نورموبلاستوز و قطعات مگاکاریوسیت در لکه خون معمولاً مشخص می شود. تقریباً در 10-15٪ از بیماران در مرحله CD ، نفوذهای بلاست خارج از حفره ظاهر می شوند.
کمتر معمولاً ضایعاتی در سیستم عصبی مرکزی وجود دارد که علائم نورولوسمی یا آسیب به اعصاب محیطی را دارند. بعضی از بیماران مبتلا به CD در اثر لکوستاز و نفوذ لوسمی در جسم غارنوسیم دارای لوسمید پوستی یا پریاپیسم هستند. لازم به ذکر است که ، در برخی موارد ، در حضور کانونهای خارج از ماسه نفوذ بلاست ، ممکن است در تصویر خون محیطی و مغز استخوان نشانه هایی از انتقال CML به فاز CD دیده نشود.
طبق طبقه بندی WHO (2002) ، معیارهای زیر برای FA و CD تفکیک شده است.
مرحله شتاب در حضور یک یا چند علامت:
10-10٪ در خون محیطی یا مغز استخوان ،
- بازوفیل ها در خون محیطی کمتر از 20٪ ،
- ترومبوسیتوپنی مداوم (کمتر از 100.0x10 9 / l) یا ترومبوسیتوز مداوم بیش از 1000.0x10 9 / l ، با وجود درمان مداوم ،
- با وجود ادامه درمان ، افزایش اندازه طحال و افزایش سطح لکوسیت ها ،
- داده های سیتوژنتیک به نفع تکامل کلونال (علاوه بر ناهنجاری های سیتوژنتیک مشخص شده در هنگام تعیین تشخیص CP CML) ،
- تکثیر مگاکاریوسیتی به صورت خوشه ای در ترکیب با فیبروز رتیکولین و کلاژن قابل توجه و یا دیسپلازی گرانولوسیتی شدید.
مرحله بحران قدرت با یک یا چند علامت:
انفجار 20٪ یا بیشتر در خون محیطی یا مغز استخوان ،
- تکثیر انفجار خارج از بینی ،
- تجمع یا خوشه انبوه در مغز استخوان با ترپانوبیوپسی.
فاز مزمن CML در غیاب معیارهای مرحله FA و CD ایجاد می شود.
اسپلنومگالی و هپاتومگالی از هر اندازه که باشد نشانه FA و BCML نیست.
با توجه به داده های معاینه اولیه بیمار ، تعیین نه تنها مرحله CML بلکه همچنین گروه خطر ابتلا به بیماری در شروع بیماری بسیار مهم است. J.E.Sokal و همکاران در سال 1987 ، یک مدل پیش آگهی با در نظر گرفتن چهار علامت ارائه شد: سن بیمار در زمان تشخیص ، اندازه طحال ، تعداد پلاکت ها و تعداد بلاست در خون. این مدل بیشترین کاربرد را دارد و در بیشتر مطالعات استفاده می شود.
شاخص پیش آگهی با استفاده از فرمول محاسبه می شود:
شاخص Sokal \u003d exp (0.0116 (سن - 43.4) + 0.0345 (اندازه طحال - 7.51) + 0.188 [(تعداد پلاکت: 700) 2 - 0.563] + 0.0887 (تعداد بلاست در خون - 2.10))
Exp (توان) -2.718 به توان عددی که در مهاربندها نشان داده می شود افزایش می یابد.
با شاخص کمتر از 0.8 - یک گروه کم خطر ؛ با شاخص 0.8-1.2 - یک گروه از میانگین خطر ؛ با شاخص بیش از 1.2 - یک گروه پر خطر.
روشهایی برای تشخیص سرطان خون مزمن میلوئیدی
تشخیص افتراقی CML باید با واکنش های لوسموئیدی از نوع میلوئیدی و بیماری هایی که نئوپلاسم های مزمن میلوپرولیفراتیو را نشان می دهند ، انجام شود.روش های اجباری معاینه بیماران برای ایجاد تشخیص CML شامل موارد زیر است:
بررسی مورفولوژیکی خون محیطی با محاسبه فرمول لکوسیت ها و تعداد پلاکت ها ،
- بررسی مورفولوژیکی مغز استخوان ،
از آنجا که تنها معیار قابل اعتماد برای تشخیص لوسمی میلوئیدی مزمن وجود کروموزوم Ph است ، مطالعه سیتوژنتیک مغز استخوان با تجزیه و تحلیل حداقل 20 صفحه متافاز ضروری است. اگر پاسخ منفی باشد - عدم وجود t (9؛ 22) (q34؛ q11) - با احتمال زیاد تشخیص CML ، لازم است از روشهای ژنتیکی مولکولی-FISH (فلورسانس در هیبریداسیون درجا) استفاده کنید یا واکنش زنجیره ای پلیمراز (PCR),
- لمس و تعیین سونوگرافی اندازه طحال ، کبد ، غدد لنفاوی. از آنجایی که اسپلنومگالی یا هپاتومگالی از هر اندازه معیارهای فاز FA یا CD نیستند ، آسیب خاص به اندام ها و بافت های دیگر باید نشانه ای از تبدیل بیماری به CD باشد.
تایپ HLA برای نامزدهای احتمالی برای پیوند سلول های بنیادی خونساز آلوژنیک (allo-HSCT) برای بیماران مبتلا به CML در FA و BC نشان داده شده است ، که هیچ منع استفاده از این روش درمانی ندارند ،
- برای بیماران در مرحله CD CML ، آزمایش سیتوشیمیایی و ایمونوفنوتیپ برای تعیین نوع بلاست ها نشان داده شده است.
روش های اختیاری بررسی شامل موارد زیر است:
ترپانوبیوپسی برای ارزیابی وجود و میزان فرآیند فیبروز در مغز استخوان ،
- روش های بررسی ابزاری - معاینه سونوگرافی (سونوگرافی), تصویربرداری تشدید مغناطیسی (MRI)، پنچری کمر به منظور تعیین وجود کانون های خارج از حفره خون ،
- قبل از شروع درمان مهار کننده های تیروزین کیناز (TKI) انجام PCR برای تعیین سطح اولیه بیان ژن BCR-ABL توصیه می شود.
درمان سرطان خون مزمن میلوئیدی
برای چندین دهه ، CML درمانی تسکین دهنده باقی ماند. رفتار هیدروکسی اوره (HU)، بوسولفان (میلوزان ، میلران) کیفیت زندگی بیماران را بهبود بخشید ، اما بقای کلی را افزایش نداد.درمان استاندارد Ph + CML که توسط متخصصان انجمن خون شناسی آمریکا در سال 1998 توصیه شده است ، شامل HU ، اینترفرون نوترکیب a (rINF)بدون یا در ترکیب با دوزهای پایین سیتوزار (LDAC)، ITK (مهار کننده های تیروزین کیناز) - مزیلات ایماتینیب و آلو- HSCT. ترکیب rINF + LDAC برتر از HU بود. مزیت استفاده از IM با دوز 400 میلی گرم در روز در مقایسه با rINF + LDAC.
allo-HSCT استاندارد باعث بهبودی یا بهبودی مولکولی طولانی مدت در 50٪ بیماران می شود ، با تفاوت معنی داری هنگام در نظر گرفتن گروه های خطر. در کشورهایی که درمان TKI در دسترس است و allo-HSCT انجام می شود ، هر دو این استراتژی ها از یکدیگر جدا نیستند ، اگرچه پس از ورود TKI به عمل بالینی ، در 7 سال گذشته کاهش تعداد سالانه allo-HSCT قابل توجه بوده است.
اثربخشی درمان با معیارهای زیر تعیین می شود:
1. وجود بهبودی خون شناسی: داده های آزمایش خون:
- بهبودی کامل بالینی و خون (CHR):
- پلاکت زیر 450.0x10٪ ،
- لکوسیت های زیر 10.0x10 ،
- در انفجارهای لکوگرام کمتر از 5٪ است ، هیچ گرانولوسیت نابالغی وجود ندارد.
2. وجود بهبودی سیتوژنتیک: وجود کروموزوم Ph:
کامل - 0٪ ،
- جزئی - 1-35 ،
- کوچک - 36-65٪ ،
- حداقل - 66-95٪
3. وجود بهبودی مولکولی: وجود نسخه BCR-ABL:
کامل - متن تعریف نشده است ،
- بزرگ - 0.1٪
سیتوژنتیک کامل (CCyR)و بهبود نسبی سیتوژنتیک (PCyR)در ترکیب می تواند به عنوان مشاهده شود بهبود بزرگ سیتوژنتیک (MCyR). بهبود بزرگ مولکولی (MMolR)برابر است با کاهش 1000 برابری از 100٪ پایه.
بهبود کامل مولکولی (CMolR) اطمینان حاصل شود که متن BCR-ABL توسط RQ-PCR (واکنش زنجیره ای پلیمراز کمی در زمان واقعی) تشخیص داده نشود.
گزینه های درمان سرطان خون میلوئیدی مزمن
در حال حاضر ، استفاده از هیدروکسی اوره (HU) می تواند توصیه شود:به منظور دستیابی به سلول سلولی ،
- در دوران بارداری برای حفظ پاسخ خون ،
- در موارد مقاومت و / یا عدم تحمل داروهای اینترفرون یا TKI ،
- اگر انجام allo-HSCT غیرممکن باشد ،
- اگر تهیه CML با تعداد کافی ITC در بیماران غیرممکن باشد.
به طور معمول ، HU درمانی شامل تجویز این دارو با دوز 3/2 گرم در روز در ترکیب با آلوپورینول در دوز روزانه 600 - 800 میلی گرم با آبرسانی کافی است. دوز بسته به میزان کاهش سطح لکوسیت ها تنظیم می شود ، هنگامی که آنها به 10.0 10 10 9 در لیتر کاهش می یابد ، آنها به مصرف دوز نگهدارنده روی می آورند - 0.5 گرم در روز با یا بدون آلوپورینول. مطلوب است که تعداد لکوسیت ها در سطحی بالاتر از 6-8.0x10 9 در لیتر حفظ نشود.
در صورت کاهش تعداد لکوسیت های زیر 3.0x10 9 / l ، دارو به طور موقت قطع می شود. دارو به خوبی تحمل می شود ، اما با استفاده طولانی مدت ، ممکن است زخم معده ایجاد شود.
معرفی داروهای rINF در عمل امکان دستیابی در برخی از بیماران CML را نه تنها طولانی مدت بالینی و هماتولوژیکی ، بلکه بهبودی سیتوژنتیک را نیز ممکن کرد ، اگرچه فرکانس پاسخ کامل سیتوژنتیک (CCyR) کم بود - 1015. ترکیبی از داروهای rINF + LDAC میزان CCyR را کمی افزایش داد (25-30٪) ، اما دیر یا زود بیماری تقریباً در همه بیماران این گروه پیشرفت کرد.
RINF درمانی
در ابتدا برای کاهش تعداد لکوسیتها به 10.0x10 به بیماران HU تجویز می شود 9 / l ، پس از آن rINF در دوز زیر تجویز می شود:هفته اول: روزانه 3 میلیون U / m2 زیر جلدی ،
- هفته های 2 و 3: روزانه 5 میلیون U / m ،
- در آینده ، دارو با 5 میلیون IU / m2 زیر جلدی یا هر بار 3 بار در هفته تجویز می شود.
این دارو می تواند باعث واکنش های آلرژیک ، تب ، خارش پوست ، درد عضلانی (معمولاً در ابتدای استفاده) شود. درمان معمولاً 2 سال طول می کشد ، پس از آن کنترل دارو کنترل می شود.
با ترکیب rINF + LDAC (سیتوزار با دوز 20 گرم در مترمربع زیر جلد 2 بار در روز و به مدت 10 روز در ماه) ، پاسخ سیتوژنتیک بیشتر از rINF به تنهایی بود ، اما هیچ تفاوتی در بقای کلی وجود نداشت.
مقایسه نتایج حاصل از استفاده از rINF با دوز 3 میلیون U / m3 3 بار در هفته و با دوز 5 میلیون U / m3 روزانه نشان داد که دوزهای کم از نظر اثربخشی با دوزهای بالا برابر هستند ، اما بهتر تحمل می شوند. با این حال ، در تمام بیمارانی که تحت چنین درمانی قرار دارند ، وجود حداقل بیماری باقیمانده مشخص شد ، که این امر حتمی بودن عود را نشان می دهد.
در عمل بالینی معمول ، استفاده متوالی یا ترکیبی از MI یا TKI جدید با داروهای rINF هنوز توصیه نمی شود ، زیرا نتایج آزمایشات بالینی مداوم ناشناخته است. در حال حاضر ، استفاده از rINF را می توان در همان مواردی که درمان با هیدروکسی اوره توصیه می شود ، توصیه کرد.
Allo-HSCT به عنوان یک درمان خط اول در حضور اهدا کننده سازگار با HLA و همچنین سن بیمار زیر 50-55 سال ، از اوایل دهه 90 قرن بیستم به یک توصیه استاندارد برای بیماران با CML اولیه تشخیص داده شده است. Allo-HSCT تنها روشی در نظر گرفته شده است که قادر به از بین بردن کامل یک کلون لوسمیک سلول از بدن است.
با این حال ، چندین مشکل وجود دارد که استفاده گسترده از آن را در بیماران مبتلا به CML محدود می کند:
شیوع در جمعیت بیماران CML در گروه سنی 50-60 سال ،
- عدم توانایی اکثر بیماران در یافتن یک اهدا کننده مرتبط یا غیر مرتبط با HLA ،
- مرگ و میر تا 20٪ در اوایل دوره پس از پیوند از عوارض پلی شیمی درمانی (PCT)یا واکنش های پیوند در مقابل میزبان (GVHD).
در FA ، تصمیم برای انجام allo-TGSC باید با در نظر گرفتن داده های زیر گرفته شود:
ارزیابی خطر پیشرفت لوسمی میلوئیدی مزمن (طبق شاخص Sokal) ،
- تعیین کارایی ITC با در نظر گرفتن سیتوژنتیک و داده های PCR ،
- ارزیابی خطر عوارض پیوند و پس از پیوند ،
- در دسترس بودن اهدا کننده موجود
طبق توصیه های EBMT ، در CML ، allo-HSCT در CP ، FA یا CP دیررس از یک اهدا کننده سازگار مرتبط یا غیر مرتبط نشان داده می شود ، از اهدا کننده ناسازگار غیر مرتبط نشان داده نمی شود. مشکل انجام Auto-TGSC در دست توسعه است. در مرحله CD ، آلوئه یا HSCT خودکار نشان داده نشده است.
اگر تصمیمی برای انجام allo-HSCT اتخاذ شود ، این سال مطرح می شود كه کدام رژیم شرطی سازی را به بیمار ارائه می دهد: میلوآبلاژی یا غیرمیلوبیلی. یکی از رژیم های میلوآبلاژی برای انجام allo-HSCT در بیماران CML ، BuCy است: بوسولفان با دوز 4 میلی گرم بر کیلوگرم وزن بدن در روز و سیکلوفسفامید 30 میلی گرم بر کیلوگرم وزن بدن در روز به مدت 4 روز قبل از allo-HSCT.
رژیم غیر میلوآبلاژی (کاهش یافته) Bu-Flu-ATG شامل یک بار مصرف ترکیبی از بوسولفان با دوز 8 میلی گرم در کیلوگرم وزن بدن ، فلودرآبین 150 میلی گرم در مترمربع و گلوبولین ضد تیروسیت خرگوش با دوز 40 میلی گرم است. اما به دلیل عدم وجود آزمایشات تصادفی ، این گزینه به عنوان استاندارد مراقبت توصیه نمی شود.
آگاهی از نقش فعالیت تیروزین کیناز (TCA) پروتئین BCR-ABL در روند میلوپرولیفراسیون منجر به سنتز یک سری جدید از داروها با هدف قرار دادن پروتئین های رمزگذاری شده توسط BCR-ABL شد. مهار TCA منجر به قطع سیگنالهایی می شود که فنوتیپ سرطان خون را کنترل می کنند. اولین مهار کننده TCA ، متیلات ایماتینیب (IM) ، دارای فعالیت بیوشیمیایی بالا و نسبتاً خاصی در CML است که منجر به معرفی سریع آن در عمل بالینی می شود.
با ظهور ITK ، نشانه های allo-HSCT به طرز چشمگیری تغییر کرده است. در CP CML اولیه ، allo-HSCT در ایجاد مقاومت یا عدم تحمل TKI ها نشان داده می شود ؛ بنابراین ، در حال حاضر اجرای آن در بیماران بزرگسال به عنوان یک درمان خط اول توصیه نمی شود.
با این حال ، این قاعده دو استثنا دارد:
در عمل کودکان ، استفاده از allo-HSCT به عنوان یک درمان اولیه در حضور اهدا کننده مرتبط با HLA ترجیح داده می شود ،
- اگر هزینه درمان پیشنهادی برای TKI به طور قابل توجهی از هزینه allo-HSCT بیشتر باشد.
به طور کلی ، در صورت امکان ، درمان اولیه برای MI برای اکثر بیماران مبتلا به CML در CP توصیه می شود.
ایماتینیب مزیلات (IM)- گلیوک ، که یک مهار کننده تیروزین کیناز است ، در کلینیک در سال 1995 مورد استفاده قرار گرفت. IM (2-فنیل آمینوپیریمیدین) به طور موثر فعالیت کیناز پروتئین BCR-ABL را مسدود می کند و می تواند سایر پروتئین ها را با فعالیت پروتئین کیناز لازم برای بقای سلول طبیعی مسدود کند.
مطالعات نشان داده است که MI به طور انتخابی از تکثیر سلولی در سرطان خون میلوئیدی مزمن جلوگیری می کند. این دارو عمدتا توسط کبد از بین می رود ، 50 درصد کاهش در غلظت پلاسما حدود 18 ساعت است. دوز اولیه توصیه شده دارو 400 میلی گرم در روز است که به شما امکان می دهد به آن دست یابید پبهبودی کامل بالینی و خون (CHR) در 95٪ و CCyR در 76٪ موارد. در گروه بیماران مبتلا به CCyR بهبود بزرگ مولکولی (MMolR)فقط در 57٪ موارد مشخص شد.
استفاده از MI در CP "دیررس" با همان دوز ، دستیابی به CCyR را در 41-64٪ با زنده ماندن بدون پیشرفت در 69٪ بیماران امکان پذیر می کند. هنگامی که MI در FA با دوز 600 میلی گرم در روز مورد استفاده قرار گرفت ، CHR در 37٪ ، CCyR در 19٪ موارد و PFS سه ساله در 40٪ بیماران به دست آمد. هنگام استفاده از MI در همان دوز در BC CML ، CHR در 25٪ به دست آمد ، PFS کمتر از 10 ماه بود ، بقا به طور کلی بیش از 3 سال - در 7٪ موارد.
از آنجا که بروز CCyR در بیماران تحت درمان با MI بسیار زیاد است ، اندازه گیری سطح رونوشت BCR-ABL برای تعیین وجود حداقل بیماری باقیمانده (MRD)... فراوانی عدم وجود این متن به عنوان CMolR در نظر گرفته می شود ، بسیار متغیر است و از 4 تا 34 درصد است. نشان داده شده است که سلولهای بنیادی Ph + نسبت به مولدهای دیررس Ph + نسبت به MI حساسیت کمتری دارند.
در مورد اثر غیربهینه از مصرف MI در CP با دوز 400 میلی گرم در روز ، پیشنهاد می شود که دوز دارو به 600-800 میلی گرم در روز افزایش یابد ، به شرطی که مقاومت MI با جهش های اضافی BCR-ABL همراه نباشد. دریافت MI با دوز 600 میلی گرم در روز به طور قابل توجهی در FA و BC موثرتر است. در بیماران CP با مقاومت خون و سیتوژنتیک در برابر MI با دوز 400 میلی گرم در روز ، افزایش دوز MI به 800 میلی گرم در روز باعث CHR در 65٪ و CCyR در 18٪ بیماران می شود.
برخی از عوارض ممکن است هنگام استفاده از MI رخ دهد:
کم خونی و / یا پان سیتوپنی
- ادم infraorbital ، به ندرت - ادم عمومی ،
- درد در استخوان ها و مفاصل ،
- کاهش سطح کلسیم و فسفر در خون ،
- خارش پوست
تا به امروز ، دو دارو از گروه TKI برای استفاده به عنوان داروهای خط دوم برای CML درمانی در موارد مقاومت به MI وجود دارد: dasatinib و nilotinib.
Dasatinib (اسپریسل) یک مهار کننده کینازهای ABL است (در کل حدود 50 کیناز را مهار می کند) و با MI تفاوت دارد زیرا می تواند ترکیبات فعال و غیرفعال (باز و بسته) دامنه ABL کیناز را متصل کند و همچنین خانواده Src kinase را مهار می کند ، از جمله سرک و لین
می توان آن را به عنوان یک بازدارنده دوگانه مشاهده کرد. Dasatinib 300 برابر قوی تر از MI است ، و همچنین در برابر بیشتر زیرکلون های جهش یافته مقاوم به MI فعال است ، به استثنای کلون T315I و احتمالاً کلون جهش یافته F317L. این دارو برای درمان بیماران CML با مقاومت یا عدم تحمل MI استفاده می شود. بهبودی در بیماران با جهش کیناز و در غیاب ، به جز جهش های T315I به همان میزان مشاهده شد.
این دارو می تواند به صورت نوتروپنی ، ترومبوسیتوپنی ، استفراغ ، اسهال ، خونریزی دستگاه گوارش ، ورم عمومی ، بثورات پوستی ، فشار خون بالا ، COPD ایجاد عوارضی کند. در بیماران جدا شده ، ممکن است افیوژن پلور و پریکارد باشد. برای اصلاح عوارض ، باید از مصرف دارو استراحت کنید ، داروهای ادرار آور ، کورتیکواستروئیدها و در صورت لزوم توراکوسنتز را تجویز کنید.
دوز 100 میلی گرم یک بار در روز از نظر کارآیی با دوز 70 میلی گرم دو بار در روز قابل مقایسه است ، اما تحمل بهتری دارد.
Nilotinib (tasigna) مشتق آمینوپیریمیدین است ، به عنوان مثال مشتقات اصلاح شده MI ، که طیف مهار مشابه آنها را توضیح می دهد (چهار MC را مهار می کند). این دارو توانایی بیشتری در اتصال ناحیه ATP آنكوپروتئین BCR-ABL دارد. 20-50 برابر موثرتر از MI در برابر سلولهای لوسمیک حساس به MI است و همچنین در برابر تمام رده های سلولی مقاوم به MI با جهش های حوزه ABL کیناز فعال است ، به استثنای جهش T315I و احتمالاً کلون جهش یافته Y253H.
در گروه بیماران مبتلا به CP CML مقاوم به سکته قلبی ، CHR در 71٪ و CCyR در 48٪ بیماران به دست آمد. میزان بقای 2 ساله کلی در این گروه 95٪ بود. هیچ تفاوتی در تعداد بهبودی در بیماران با یا بدون جهش در حوزه ABL کیناز وجود ندارد. هنگام استفاده از دارو در FA یک ماه پس از شروع درمان ، CHR در 55٪ موارد ثبت شد ، بقای کلی بعد از 12 ماه 82٪ بود. در مرحله CD ، با درمان به مدت 12 ماه ، میزان بقای کلی 47٪ بود.
خارش پوست
- یبوست،
- افزایش سطح آنزیم های کبدی ،
- افزایش سطح بیلی روبین غیر مستقیم ،
- بثورات روی پوست.
برای dasatinib ، کاهش 50 درصدی در سطح پلاسما 3-5 ساعت ، برای nilotinib و MI - 15-18 ساعت است. برای dasatinib ، مهار طولانی مدت پروتئین BCR-ABL لزوماً به معنای از بین بردن سلول های لوسمی در سرطان خون میلوئیدی مزمن نیست. بنابراین ، فرضیه شیوع اثربخشی مهار طولانی مدت کینازها در درمان CML برای داروی dasatinib قابل استفاده نیست.
به طور کلی ، داروی dasatinib و nilotinib تقریباً در بیماران بدون بهره از MI درمانی قدرت یکسانی دارند. با این حال ، هیچ یک از این موارد برای استفاده در بیماران مبتلا به کلون جهش یافته N315I توصیه نمی شود.
داروی بوزوتینیب که باعث مهار ABL و Srk کینازها می شود و بنابراین یک مهار کننده دو کیناز است ، در آزمایشات بالینی قرار دارد. این ماده در برابر رده های سلولی حامل جهش در سه حوزه از چهار حوزه کیناز فعال است. با این حال ، باید در نظر داشت که استفاده از داروهای فوق درمان کاملی را ایجاد نمی کند.
پس از استفاده از ایماتینیب ، در صورت ایجاد مقاومت در برابر دارو ، همراه با عدم تحمل یا عوارض شدید ، باید به بیماران درمان خط 2 درمان TKI ارائه شود.
- انتخاب دارو باید با توجه به میزان سمیت آن تعیین شود.
Allo-TGSK برای موارد زیر ارائه می شود:
وجود جهش های T315I و سایر جهش ها ،
- هیچ تاثیری در درمان ITK در FA و BC ،
- عدم تأثیر در درمان TKI خط 2 درمان.
- پیشگیری از سرطان خون مزمن میلوئیدی
- در صورت ابتلا به سرطان خون مزمن میلوئید با کدام یک از پزشکان تماس بگیرید
سرطان خون میلوئیدی مزمن چیست
سرطان خون میلوئیدی مزمن (CML) رتبه سوم را در بین همه سرطان خون دارد. حدود 20٪ از سرطان های خون را تشکیل می دهد. در حال حاضر ، بیش از 3 هزار بیمار در روسیه ثبت شده است. کوچکترین آنها فقط 3 سال سن دارد ، بزرگترین آنها 90 ساله است.
بروز CML 1-1.5 مورد در هر 100000 نفر جمعیت در سال است (15-20٪ کل موارد هموبلاستوز در بزرگسالان). بیشتر افراد میانسال بیمار هستند: اوج بروز آن در سنین 30-50 سالگی اتفاق می افتد ، حدود 30٪ بیماران بالای 60 سال هستند. CML در کودکان نادر است و بیش از 2-5٪ از کل لوسمی ها را تشکیل نمی دهد. مردان کمی بیشتر از زنان بیمار می شوند (نسبت 1: 1.5).
چه عواملی باعث سرطان خون میلوئیدی مزمن می شوند
مانند اکثر قریب به اتفاق لوسمی های دیگر ، سرطان خون میلوئیدی مزمن در نتیجه آسیب اکتسابی (یعنی نه مادرزادی) به دستگاه کروموزومی سلول بنیادی تک مغز استخوان ایجاد می شود.
علت دقیق این تغییر در کروموزوم ها در بیماران CML هنوز ناشناخته است. به احتمال زیاد ، یک تبادل تصادفی از مواد ژنتیکی بین کروموزوم ها وجود دارد ، که در یک مرحله خاص از زندگی سلول در نزدیکی یکدیگر قرار دارند.
سوال در مورد تأثیر عواملی مانند دوزهای کم تشعشع ، تشعشع الکترومغناطیسی ضعیف ، علف کش ها ، حشره کش ها و غیره در بروز CML همچنان بحث برانگیز است. افزایش بروز CML در افراد در معرض تابش یونیزان به طور قابل اعتماد اثبات شده است. در میان عوامل شیمیایی ، ارتباط با وقوع CML فقط برای گاز بنزن و خردل برقرار شد.
بستر سرطان خون مزمن میلوئیدی به طور عمده سلولهای بالغ و بالغ سری گرانولوسیتی هستند (سلولهای متامیلوسیت ، گرانولوسیت های چاقویی و قطعه قطعه شده).
بیماری زایی (چه اتفاقی می افتد؟) در طول لوسمی میلوئیدی مزمن
اعتقاد بر این است که نقش اصلی در بروز سرطان خون مزمن میلوئیدی با جابجایی t (9؛ 22) بازی می شود ، که منجر به تشکیل ژن کایمریک BCR-ABL1 می شود. در این حالت ، اگزون 1 ژن ABL1 با تعداد متفاوتی از اگزونهای 5'-انتهایی ژن BCR پروتئین های Chimeric Bcr-Abl جایگزین می شود (یکی از آنها پروتئین p210BCR-ABL1 است) حاوی ناحیه N ترمینال Bcr و حوزه C ترمینال Abl1 است.
توانایی پروتئینهای کایمریک در القا trans تحول تومور سلولهای بنیادی خونساز در آزمایشگاه اثبات شده است.
سرطان زایی پروتئین p210BCR-ABL1 نیز با آزمایش روی موش هایی که یک دوز مرگبار تابش دریافت کرده اند ، اثبات می شود. هنگامی که آنها با سلولهای مغز استخوان آلوده به رترو ویروس حامل ژن BCR-ABL1 پیوند شدند ، نیمی از موش ها دچار سندرم میلوپرولیفراتیو ، شبیه سرطان خون میلوئیدی مزمن شدند.
شواهد دیگر در مورد نقش پروتئین p210BCR-ABL1 در ایجاد لوسمی میلوئیدی مزمن از آزمایش با اولیگونوکلئوتیدهای ضد حس مکمل نسخه رونوشت ژن BCR-ABL1 ناشی می شود. نشان داده شد که این اولیگونوکلئوتیدها رشد کلنی های سلول های توموری را سرکوب می کنند ، در حالی که کلنی های گرانولوسیتیک و ماکروفاژ طبیعی به رشد خود ادامه می دهند.
همجوشی ژن BCR با ژن ABL1 منجر به این واقعیت می شود که فعالیت تیروزین کیناز پروتئین Abl1 افزایش می یابد ، توانایی آن برای اتصال به DNA ضعیف می شود و اتصال به اکتین افزایش می یابد.
در همان زمان ، مکانیزم دقیق تبدیل سلولهای مغز استخوان طبیعی به سلولهای توموری ناشناخته است.
مکانیسم انتقال بیماری از مرحله پیشرفته به بحران بلاست نیز مشخص نیست. شکنندگی کروموزوم در کلون تومور ذاتی است: علاوه بر جابجایی t (9؛ 22) ، تریزومی در کروموزوم 8 ، حذف در 17p ممکن است در سلولهای تومور ظاهر شود. تجمع جهش ها منجر به تغییر در خصوصیات سلول های تومور می شود. به گفته برخی محققان ، میزان پیشرفت بحران انفجار بستگی به محلی سازی نقطه شکست ژن BCR دارد. محققان دیگر این داده ها را رد می کنند.
در تعدادی از بیماران ، ایجاد بحران بلاست با جهش های مختلفی در ژن TP53 و ژن RB1 همراه است. جهش های ژنی RAS نادر است. گزارش های جداگانه ای از ظهور پروتئین p190BCR-ABL1 در بیماران مبتلا به لوسمی میلوئیدی مزمن وجود دارد (که اغلب در بیماران مبتلا به لوسمی لنفوبلاستیک حاد و گاهی اوقات در بیماران مبتلا به لوسمی میلوئیدی حاد مشاهده می شود) ، و همچنین جهش در ژن MYC.
قبل از بحران انفجار ، متیلاسیون DNA در محل ژن BCR-ABL1 می تواند رخ دهد.
همچنین اطلاعاتی در مورد مشارکت IL-1beta در پیشرفت سرطان خون میلوئیدی مزمن وجود دارد.
داده های ارائه شده نشان می دهد که پیشرفت تومور به دلیل چندین مکانیسم است ، اما نقش دقیق هر یک از آنها ناشناخته است.
علائم لوسمی میلوئیدی مزمن
لحظه وقوع سرطان خون میلوئیدی مزمنمانند هر سرطان خون دیگر ، هیچ علامتی ندارد و همیشه مورد توجه قرار نمی گیرد. علائم زمانی گسترش می یابد که تعداد کل سلولهای تومور از 1 کیلوگرم بیشتر شود. بیشتر بیماران از ناراحتی عمومی شکایت دارند. آنها زودتر خسته می شوند و ممکن است در حین کار بدنی دچار تنگی نفس شوند. در نتیجه کم خونی ، پوست رنگ پریده می شود. بیماران ممکن است در شکم سمت چپ ناراحتی ناشی از بزرگ شدن طحال را تجربه کنند. کاهش وزن ، افزایش تعریق ، کاهش وزن و عدم توانایی در تحمل گرما غیر معمول نیست. در معاینه بالینی ، غالباً تنها علامت پاتولوژیک بزرگ شدن طحال است. در مرحله اولیه CML عملاً هیچ افزایشی در اندازه کبد و غدد لنفاوی مشاهده نمی شود. در حدود یک چهارم بیماران ، سرطان خون میلوئیدی مزمن کاملاً تصادفی و طی یک معاینه پزشکی معمول کشف می شود. گاهی اوقات تشخیص CML در مرحله تهاجمی تر - شتاب یا بحران انفجار - انجام می شود.
سرطان خون میلوئیدی مزمن (میلووز مزمن) در دو مرحله اتفاق می افتد.
مرحله اول خوش خیم است ، چندین سال طول می کشد و با بزرگ شدن طحال مشخص می شود.
مرحله دوم بدخیم است و 3-6 ماه طول می کشد. طحال ، کبد ، غدد لنفاوی بزرگ شده ، نفوذ لوسمیک پوست ، تنه های عصبی و مننژ ظاهر می شود. سندرم هموراژیک ایجاد می شود.
بیماری های عفونی اغلب ثبت می شوند. علائم مسمومیت معمول است - ضعف ، تعریق. گاهی اوقات اولین علامت درد جزئی ، سنگینی در هیپوکندری سمت چپ است ، که با افزایش طحال همراه است ، بعدا سکته های طحال وجود دارد. بدون هیچ دلیل مشخصی ، دما افزایش می یابد ، دردهای استخوان ظاهر می شود.
در یک مورد معمول ، لکوسیتوز نوتروفیل (افزایش سطح لکوسیت های نوتروفیل) با ظهور اشکال جوان نوتروفیل ، همراه با افزایش تعداد پلاکت ها ، کاهش محتوای لنفوسیت ها ، مشخصه است. با پیشرفت بیماری ، کم خونی و ترومبوسیتوپنی افزایش می یابد. در کودکان ، شکل جوانی لوسمی میلوئیدی مزمن اغلب بدون افزایش تعداد پلاکت ها ، اما با افزایش محتوای مونوسیت ها مشاهده می شود. تعداد بازوفیل ها اغلب افزایش می یابد و سطح ائوزینوفیل ها افزایش می یابد. در اولین مرحله خوش خیم ، سلولهای مغز استخوان از همه لحاظ طبیعی هستند. در مرحله دوم ، فرمهای بلاست در مغز استخوان و خون ظاهر می شود ، و یک افزایش سریع در تعداد لکوسیت ها در خون وجود دارد (تا چند میلیون در 1 میکرولیتر). علائم مشخصه مرحله نهایی تشخیص قطعات هسته مگاکاریوسیت در خون ، سرکوب خونسازی طبیعی است.
این بیماری به طور مزمن با دوره های تشدید و بهبودی پیش می رود. متوسط \u200b\u200bامید به زندگی 3-5 سال است ، اما موارد منفرد دوره طولانی مدت لوسمی میلوئید مزمن (تا 10-20 سال) شناخته شده است. تصویر بالینی به مرحله بیماری بستگی دارد.
پیش بینیمبهم است و به مرحله بیماری بستگی دارد. طی دو سال اول پس از تشخیص ، 10٪ بیماران هر سال بعد می میرند - کمی کمتر از 20٪. بقای متوسط \u200b\u200bتقریباً 4 سال است.
از مدل های پیش بینی برای تعیین مرحله بیماری و خطر مرگ استفاده می شود. غالباً اینها مدلهای مبتنی بر تجزیه و تحلیل چند متغیره از مهمترین علائم پیش بینی کننده هستند. یکی از آنها - شاخص سوکال - درصد سلولهای بلاست در خون ، اندازه طحال ، تعداد پلاکت ، اختلالات سیتوژنتیک اضافی و سن را در نظر می گیرد. مدل تور و مدل ترکیبی کانتارجان تعداد علائم پیش آگهی نامطلوب را در نظر می گیرند. این ویژگی ها عبارتند از: سن 60 سال به بالا. طحال قابل توجه (قطب پایین طحال از هیپوکندری چپ 10 سانتی متر یا بیشتر بیرون می زند) ؛ محتوای سلولهای بلاست در خون یا مغز استخوان به ترتیب برابر یا بیشتر از 3٪ و 5٪ ؛ محتوای بازوفیل در خون یا مغز استخوان به ترتیب برابر یا بیش از 7٪ و 3٪ باشد. یک سطح پلاکت برابر یا بیش از 700000 میلی لیتر در میکرولیتر ، و همچنین تمام علائم مرحله شتاب. در صورت وجود این علائم ، پیش آگهی بسیار ضعیف است. خطر مرگ در سال اول بیماری سه برابر بیشتر از حد معمول است.
تشخیص سرطان خون مزمن میلوئیدی
عکس مغز استخوان و خون در یک مورد معمول ، لکوسیتوز نوتروفیل با ظهور اشکال جوان نوتروفیل ، همراه با هیپرترومبوسیتوز ، لنفوسیتوپنی مشخصه است. با پیشرفت بیماری ، کم خونی و ترومبوسیتوپنی افزایش می یابد. کودکان غالباً یک نوع نوجوانان از لوسمی میلوئیدی مزمن بدون هیپرترومبوسیتوز ، اما با مونوسیتوز بالا دارند. تعداد بازوفیل ها اغلب افزایش می یابد و ائوزینوفیلی رخ می دهد. در اولین مرحله خوش خیم ، سلولهای مغز استخوان از همه لحاظ طبیعی هستند. در مرحله دوم ، فرمهای بلاست در مغز استخوان و خون ظاهر می شود ، و یک افزایش سریع در تعداد لکوسیت ها در خون وجود دارد (تا چند میلیون در 1 میکرولیتر). علائم مشخصه مرحله ترمینال تشخیص قطعات هسته مگاکاریوسیت در خون ، سرکوب خونسازی طبیعی است.
تشخیص سرطان خون مزمن بر اساس شکایت ، معاینه ، آزمایش خون ، بیوپسی ، تجزیه و تحلیل سیتوژنتیک انجام می شود. چنین روشهای معاینه کمکی مانند PET-CT ، CT ، MRI نیز در ایجاد تشخیص کمک می کند.
تشخیص با شمارش خون است. سوراخ شدن مغز استخوان بسیار مهم است. تشخیص افتراقی با لنفوگرانولوماتوز و لنفوسارکوماتوز انجام می شود.
درمان مزمن لوسمی میلوئید
در مرحله پیشرفته بیماری ، دوزهای کمی از میلوزان تجویز می شود ، معمولاً به مدت 40-20 روز. وقتی لکوسیت ها در یک میکرولیتر (15-20 گرم در لیتر) به 15000-20000 می رسند ، آنها به دوزهای نگهدارنده تبدیل می شوند. به موازات میلوزان ، از تابش طحال استفاده می شود. علاوه بر میلوزان ، تجویز میلوبروما ، 6-مرکاپتوپورین ، هگزافسفامامید ، هیدروکسی اوره نیز امکان پذیر است. در مرحله بحران بلاست ، ترکیبی از داروها نتیجه خوبی می دهد: وین کریستین-پردنیزولون ، سیتوزار-روبومایسین ، سیتوسارتیو گوانین. از پیوند مغز استخوان استفاده می شود.
سرطان خون میلوئیدی یک بیماری مستقل نیست ، اما به شرایطی اشاره دارد که با رشد زیاد و کنترل نشده سلولهای میلوئیدی در مغز استخوان قرمز و تجمع آنها در جریان خون مشخص می شود.
به طور عادی ، سرطان خون را سرطان خون نیز می نامند ، اما این اصطلاح صحیح نیست. از نظر بینی ، معمول است که دو بیماری مرتبط با این بیماری - لوسمی میلوئیدی مزمن (AMML) و حاد (AML) را از هم تشخیص دهیم.
در AML ، تقسیم عظیمی از سلولهای مولد میلوپوئتیک (بلاست) وجود دارد که نمی تواند به سلولهای بالغ تمایز یابد. طبق آمار WHO ، AML حدود 80٪ از انواع دیگر سرطان خون را تشکیل می دهد. طبق داده های نظارتی ، اغلب این بیماری بیماران زیر 15 سال و پس از 60 سال را درگیر می کند. AML از نظر جنسیت در زنان کمتر دیده می شود.
بر خلاف AML ، در CML ، سلولهای بدخیم توانایی تمایز به فرمهای بالغ را دارند. CML حدود 15٪ کل موارد سرطان خون را تشکیل می دهد. بروز سالانه تقریباً 1.6 در هر 100000 نفر جمعیت است. در اغلب موارد ، این بیماری بیماران گروه سنی 20-50 سال را تحت تأثیر قرار می دهد. در نسبت جنسیت ، مردان بیشتر از زنان بیمار می شوند ، حدود 1.5: 1.
طبقه بندی
علاوه بر ICD کلاسیک ، چندین طبقه بندی وجود دارد که به شما امکان می دهد توصیف دقیق روند آسیب شناسی را بدست آورید. در مورد لوسمی میلوئید حاد ، مهمترین آن طبقه بندی فرانسوی-آمریکایی-بریتانیایی (FAB) است که بر اساس نوع و بلوغ سلولهایی است که سرطان خون از آنها ایجاد می شود.
طبق طبقه بندی خون شناسی ، سرطان خون میلوئیدی مزمن حدود 5 زیرگروه اصلی دارد.
طبق طبقه بندی بین المللی بیماری های ویرایش دهم (ICD-10) ، به هر زیر گروه بیماری باید کد خاصی اختصاص یابد:
C92.0 - سرطان خون حاد میلوئیدی.
C92.1 - سرطان خون میلوئیدی مزمن.
C92.2 - سرطان خون میلوئیدی مزمن غیر معمولی.
C92.4 - سرطان خون حاد پرومیلوسیتیک
C92.5 - سرطان خون حاد میلومونوسیتیک.
C92.7 - سایر لوسمی های میلوئیدی.
C92.9 - لوسمی میلوئیدی نامشخص
C93.1 - سرطان خون مزمن میلومونوسیتیک
علل و عوامل خطر برای AML
سرطان خون حاد میلوئیدی در اثر آسیب به DNA سلولهای در حال رشد از نژاد میلوئید مغز استخوان ایجاد می شود ، که تولید غیر طبیعی اجزای خون را بیشتر تحریک می کند. در AML ، مغز استخوان سلولهای نابالغی به نام میلوبلاست را سنتز می کند. این سلولهای غیرطبیعی نمی توانند به درستی کار کنند و با تقسیم و رشد فراوان ، شروع به جابجایی عناصر سالم مغز استخوان می کنند.
در بیشتر موارد ، مشخص نیست که چه عواملی باعث جهش DNA می شود ، اما عوامل مختلفی در ایجاد AML شناخته شده اند ، از جمله اختلالات خون شناسی پیشین ، علل وراثتی ، قرار گرفتن در معرض محیط و اثرات دارویی. با این حال ، اکثر بیماران مبتلا به AML با شروع جدید دلیل قابل شناسایی ندارند.
اختلالات پیشین خون. شایعترین علت توسعه سندرم میلودیسپلاستیک (MDS) در نظر گرفته می شود. این یک اختلال مغز استخوان با علت ناشناخته است که اغلب در بیماران مسن رخ می دهد و با سیتوپنی پیشرونده که طی چند ماه یا چند سال ایجاد می شود ، بروز می کند. همچنین در بیماران مبتلا به این سندرم درجه بندی خطر وجود دارد. به عنوان مثال ، در کم خونی مقاوم به درمان با سیدروبلاست های حلقوی ، خطر ابتلا به AML به طور قابل توجهی کمتر از بیماران مبتلا به MDS با تعداد سلولهای بلاست افزایش یافته است.
اختلالات مادرزادی. بیماری های مادرزادی که بیماران را مستعد ابتلا به AML می کنند عبارتند از: سندرم بلوم ، سندرم داون ، نوتروپنی مادرزادی ، کم خونی فانکونی و نوروفیبروماتوز. معمولاً در این بیماران ، لوسمی میلوئید حاد از کودکی ایجاد می شود ، اما می تواند در سنین بالغ تری ظاهر شود.
در مطالعات بالینی ، اشاره شده است که خطر انتشار AML با تماس منظم با بنزن به طور قابل توجهی افزایش می یابد. از این ماده شیمیایی به عنوان حلال در صنایع مختلف (پالایشگاه های مواد شیمیایی و روغن و همچنین لاستیک و کفش) استفاده می شود. بنزن در چسب ها ، محصولات تمیز کننده ، رنگ ها و دود سیگار یافت می شود. قرار گرفتن در معرض فرمالدئید نیز با AML همراه است ، اما اثر دقیق آن هنوز مشخص نیست.

شیمی درمانی AML در بیمارانی که قبلاً شیمی درمانی شده اند بیشتر دیده می شود. برخی از داروها ارتباط تنگاتنگی با ایجاد سرطان خون ثانویه دارند ("مکلورتامین" ، "پروکاربازین" ، "کلرامبوسیل" ، "ملفالان" ، "اتوپوزید" ، "تنی پوزید" و "سیکلوفسفامید").
اگر بیمار همزمان با این داروهای شیمی درمانی پرتودرمانی دریافت کند ، خطر افزایش می یابد. لوسمی های ثانویه حدود 10 سال پس از درمان بیماری هوچکین ، لنفوم غیر هوچکین یا لوسمی لنفوسیتی حاد در کودکان رخ می دهد. لوسمی های ثانویه نیز می توانند پس از درمان سرطان های پستان ، تخمدان یا سایر موارد ایجاد شوند.
قرار گرفتن در معرض اشعه اثرات قرار گرفتن در معرض پرتوی بالا یک عامل خطر شناخته شده برای AML و همچنین سرطان خون حاد لنفوبلاستیک است. این اولین بار پس از بمباران اتمی هیروشیما و ناگازاکی در میان بازماندگان ژاپنی مورد توجه قرار گرفت. در طی 6-8 سال پس از وقایع ناگوار ، بسیاری از ژاپنی ها علائم لوسمی میلوئید حاد را پیدا کردند.
قرار گرفتن در معرض اشعه نامطلوب را می توان در طی پرتودرمانی برای درمان سرطان ، و همچنین با برخی از انواع آزمایشات تشخیصی (اشعه ایکس ، فلوروسکوپی ، توموگرافی کامپیوتری) مشاهده کرد.
علل ناشناخته است ، اما ذکر شده است که مردان بیشتر از زنان از AML رنج می برند. همچنین ، این بیماری بیشتر در قفقازی ها دیده می شود. عوامل خطر اثبات نشده شامل زندگی در منطقه ای با اشعه الکترومغناطیسی بالا ، قرار گرفتن در معرض آفت کش ها ، سفید کننده ها و رنگ های مو است.
علل و عوامل خطر برای CML
در یک فرد سالم ، سلولهای بدن حاوی 23 جفت کروموزوم در هسته خود هستند. در افرادی که از CML رنج می برند ، در سلولهای مغز استخوان ، نقض ساختار کروموزوم ها وجود دارد که شامل انتقال یک سایت از کروموزوم 22 به 9 است. کروموزوم 22 فوق کوتاه که فیلادلفیا نیز نامیده می شود (بعد از شهری که برای اولین بار کشف شد) در خون 90٪ افراد مبتلا به CML وجود دارد.
در برابر پس زمینه این تغییرات کروموزومی ، ژن های جدیدی ایجاد می شوند که شروع به تولید بیش از حد آنزیم تیروزین کیناز می کنند. متعاقباً ، مقدار زیادی تیروزین کیناز منجر به تقسیم غیرطبیعی سلولهای مغز استخوان می شود که به توسعه لوسمی میلوئید مزمن کمک می کند. گلبولهای سفید غیرطبیعی به طور طبیعی توسعه نمی یابند و نمی میرند ، اما در تعداد زیادی تقسیم می شوند ، سلول های خونی سالم را جابجا می کنند و به مغز استخوان آسیب می رسانند.
تا کنون ، دلایل دقیق ظاهر AML روشن نشده است. اکنون به طور کلی پذیرفته شده است که سرطان خون حاد میلوژن در برابر تجمع جهش ها در سلول های مولد میلوپوئیز ایجاد می شود. به استثنای برخی از خصوصیات ، عواملی که خطر ابتلا به CML را افزایش می دهند مانند AML هستند.
مصونیت ضعیف شده مطالعات بالینی نشان داده است که احتمال ابتلا به CML در افراد مبتلا به سرکوب سیستم ایمنی مانند ایدز 3 برابر بیشتر از جمعیت عمومی است. همچنین اثر سو ad داروهای سیتوستاتیک در افرادی که مجبور به استفاده از آنها پس از پیوند عضو هستند نیز مشخص شده است. در این حالت خطر دو برابر می شود.
دلایل آن کاملاً مشخص نیست ، اما پس از تجزیه و تحلیل آماری ، مشخص شد که بیماران مبتلا به بیماری های التهابی روده ، مانند کولیت اولسراتیو یا بیماری کرون ، در مقایسه با جمعیت عمومی شانس بیشتری برای ابتلا به CML دارند.

آفت کش ها. مطالعات متعددی نشان داده است که مردانی که روزانه با سموم دفع آفات (کشاورزان ، کارگران کشاورزی) در تماس هستند در معرض خطر بیشتری برای ابتلا به سرطان خون میلوئیدی مزمن قرار دارند. در مقایسه با جمعیت عمومی ، خطر حدود 40٪ افزایش می یابد.
جنسیت ، سن و سایر عوامل خطر. مانند AML ، شیوع آن در مردان اروپایی با CML بیشتر است. 4 مطالعه وجود داشت که اثرات سو ad چاقی را گزارش می کرد. اضافه وزن حدود 25٪ احتمال بیماری را افزایش می دهد.
علائم
بسیاری از تظاهرات بالینی و علائم سرطان خون میلوئیدی برای هر دو نوع حاد و مزمن با جابجایی رشد سالم مغز استخوان توسط سلول های غیر طبیعی همراه است. به همین دلیل ، 4 سندرم اصلی در طول بیماری تشخیص داده می شوند:
- کم خونی کاهش تعداد گلبول های قرمز باعث خستگی ، افزایش ضربان قلب ، رنگ پریدگی و تنگی نفس می شود.
- نقص سیستم ایمنی عدم تولید طبیعی گلبولهای سفید ، بیماران را مستعد ابتلا به عفونت می کند ، زیرا سلولهای غیرطبیعی مکانیسم های ایجاد پاسخ ایمنی کامل را ندارند.
- مسکر کننده است. علائم اولیه سرطان خون میلوئید غالباً غیر اختصاصی است و ممکن است علائم آنفولانزا یا سایر سرماخوردگی ها را تقلید کند. علائم متداول شامل تب ، خستگی ، کاهش وزن ، کم اشتهایی ، تنگی نفس ، کم خونی ، پتشی (لکه های خونریزی پوست) ، درد استخوان و مفصل است.
- خونریزی دهنده کاهش سنتز پلاکت منجر به کبودی یا خونریزی خفیف با ضربه جزئی می شود.
بعلاوه ، بزرگ شدن طحال در بیش از 50٪ موارد با CML مشاهده می شود. این می تواند به اندازه ای بزرگ برسد که شروع به فشردن اندام های شکمی کند. بزرگ شدن طحال گاهی همراه با AML است ، اما این روند معمولاً کند و بدون درد است.
به دلیل نفوذ لکوسیت ها ، برخی از بیماران تورم لثه را تجربه می کنند. در موارد نادر ، علامت اصلی AML تشکیل توده لوسمی متراکم یا تومور (کلروما) در خارج از مغز استخوان است. بزرگ شدن غدد لنفاوی و التهاب پارانئوپلاستیک پوست در AML بسیار نادر است.
مراحل
تقسیم دوره لوسمی لنفوسیتی مزمن به فازها به پزشکان اجازه می دهد تا برنامه ریزی بهتری برای درمان و پیش بینی نتیجه بیماری داشته باشند.
| مرحله مزمن | خون و مغز استخوان حاوی کمتر از 10٪ سلول بلاست است. این مرحله می تواند چندین سال طول بکشد ، اما بدون درمان کافی ، بیماری پیشرفت کرده و به مراحل بعدی رشد منتقل می شود. در حدود 90٪ بیماران ، CML در مرحله مزمن تشخیص داده می شود. تظاهرات بالینی ممکن است وجود داشته باشد. آنها معمولاً به صورت ضعف عمومی و کاهش وزن جزئی بیان می شوند و ممکن است شکم به دلیل جراحی اسپلنومگالی بزرگ شود. |
| مرحله شتاب (شتاب) | هنوز تعریف واحدی برای این فاز ارائه نشده است ، اما افزایش تعداد بلاست ها از 10 به 19 درصد یا بیش از 20 درصد بازوفیل ها در خون محیطی ، معیار اصلی انتقال است. بازوفیل ها بعضاً علاوه بر کروموزوم فیلادلفیا حاوی تغییرات سیتوژنتیکی هستند. |
| بحران انفجار | در دوره خود ، شبیه سرطان خون حاد میلوئیدی است. در این مرحله ، تعداد بلاست های حاوی تغییرات ژنتیکی اضافی به 20 درصد یا بیشتر می رسد. در 25٪ موارد ، ممکن است بلاستها در لوسمی لنفوسیتی حاد یا لوسمی حاد میلوئیدی مانند سلولهای نابالغ به نظر برسند. تظاهرات بالینی در این مرحله تب ، بزرگ شدن طحال و کاهش وزن است. |
تاکنون استانداردهایی برای تعیین مرحله سرطان خون حاد میلوئیدی تدوین نشده است ، اما معمول است که 3 مرحله اصلی را بر اساس روند کلی بیماری تشخیص دهیم.
| تازه تشخیص AML | این مرحله مربوط به سرطان خون تازه تشخیص داده شده است ، که قبلاً به طور هدفمند درمان نشده بود. ممکن است قبلاً برای علائم بیماری (تب ، خونریزی) دارویی برای بیمار تجویز شده باشد ، اما نه برای سرکوب رشد سلولهای غیرطبیعی. در این مرحله از دوره ، تا 20٪ سلولهای بلاست یافت می شود. |
| بهبودی | مرحله به این معنی است که بیمار درمان مناسب را دریافت کرده است ، که در برابر آن شمارش خون به حالت عادی بازگشت. معیار اصلی بهبودی وجود کمتر از 5٪ سلولهای بلاست در دستگاه تنفس و عدم وجود آنها در خون محیطی و مایع مغزی نخاعی است. |
| عود مجدد | تظاهرات بالینی و تغییرات پاتولوژیک در خون محیطی و آسپیرات پس از درمان بازگشت. |
شایع ترین انواع سرطان خون میلوئید
سرطان خون میلوئید حاد با بلوغ (M2) حدود 25٪ از کل موارد AML را تشکیل می دهد. زیرگروه با حرکت بخشی از کروموزوم 8 به 21 مشخص می شود. در دو طرف اتصال ، مجموعه جدیدی از DNA از قطعاتی که قبلاً پروتئین های RUNX1 و ETO را رمزگذاری کرده بودند ، تشکیل شده است. سپس این دو توالی با هم ترکیب شده و شروع به رمزگذاری یک پروتئین بزرگ به نام M2 AML می کنند که به سلول اجازه می دهد بدون مانع تقسیم شود.
سرطان خون مزمن گرانولوسیتیک بیشتر در CML دیده می شود. یعنی هر فاکتور پاتولوژیک که تغییراتی در مجموعه کروموزوم ایجاد کند ، سلولهای بلاست را تحت تأثیر قرار می دهد ، سپس از آنها گرانولوسیت تشکیل می شود. این شکل از CML در حدود 95٪ موارد رخ می دهد.
عیب یابی
برای تأیید تشخیص سرطان خون ، ممکن است چندین مطالعه انجام شود. Diagnostics همچنین به شما امکان می دهد نوع بیماری را تعیین کنید و بر اساس داده های بدست آمده ، بهترین روش درمانی را انتخاب کنید. اساس فرآیند تشخیصی در تأیید تشخیص لوسمی میلوئید حاد یا مزمن از روش های تحقیق آزمایشگاهی تشکیل شده است.
شمارش کامل خون (CBC). در اکثر بیماران ، تشخیص اولیه لوسمی میلوئیدی پس از CBC انجام می شود. ماهیت آزمایش شمارش سلولهای خونی (گلبول های قرمز ، لکوسیت ها ، پلاکت ها) است. UAC اغلب به عنوان بخشی از یک معاینه پزشکی منظم انجام می شود. در افراد مبتلا به CML ، تعداد گلبولهای سفید خون افزایش قابل ملاحظه ای خواهد داشت (که معمولاً به دلیل گرانولوسیتها است) ، همراه با ترومبوسیتوز و بازوفیلی. علاوه بر این ، عناصر لوکوپوئیز نابالغ در فرمول خون مشاهده می شود. با مهار سایر رشد مغز استخوان در بیماران ، تعداد گلبول های قرمز کاهش می یابد. به دلیل افزایش تعداد کل لکوسیت ها ، لوسمی را گاهی لوسمی می نامند.

آسپیراسیون و نمونه برداری. هیچ نشانگر توموری خاصی برای تعیین سرطان خون میلوئیدی یافت نشده است ، بنابراین در بیشتر موارد با ترکیبی از بیوپسی و آسپیراسیون تشخیص داده می شود. این تنها روش مطمئن برای تایید تشخیص است. آسپیراسیون روشی است که قسمت مایع مغز استخوان را با یک سوزن نازک خارج می کند و نمونه برداری نمونه برداری جامد را از نمونه برداری انجام می دهد. این 2 روش بسیار مشابه هستند و غالباً به طور همزمان انجام می شوند تا اطلاعات دقیق تری در مورد وضعیت مغز استخوان بدست آورند.
یک مکان معمول برای آسپیراسیون و نمونه برداری ، تاج استخوان استخوان لگن است. پس از جمع آوری مواد بیولوژیکی ، یک متخصص در زمینه آناتومی پاتولوژیک بررسی دقیق نمونه های به دست آمده را انجام می دهد. یکی از معیارهای اصلی نشان دهنده AML در بیمار وجود بیش از 20٪ بلاست در خون و تنفس است.
این تجزیه و تحلیل شامل آزمایش سلول های لوسمیک از نظر محتوای ژن های خاص ، پروتئین ها و سایر عواملی است که بدخیمی آنها را نشان می دهد. بر اساس این تحقیق ، درمان هدفمند فردی می تواند بیشتر توسعه یابد.

تحقیقات ژنتیکی. به شما امکان می دهد ژنوتیپ AML را تعیین کنید و گزینه درمانی بهینه را برای بیمار انتخاب کنید. علاوه بر این ، می توان از نتایج آزمایش در آینده برای نظارت بر روند درمان استفاده کرد.
تحقیقات سیتوژنتیک. نوعی آزمایش ژنتیکی که برای تجزیه و تحلیل کروموزوم سلول استفاده می شود. گاهی اوقات می توان این مطالعه را روی سلولهای خون محیطی انجام داد ، اما نمونه های بافتی بدست آمده از مغز استخوان برای تشخیص دقیق مورد نیاز است.
پس از شروع درمان برای CML ، آزمایش سیتوژنتیک و / یا مولکولی بر روی نمونه دیگری از مغز استخوان تکرار می شود تا تعداد سلولهای حاوی کروموزوم فیلادلفیا مجدداً شمرده شود و اثربخشی شیمی درمانی ارزیابی شود.
برای اکثر بیماران ، وجود کروموزوم فیلادلفیا و ژن همجوشی BCR-ABL نشانگر اصلی وجود CML است. در تعداد کمی از بیماران ، با وجود وجود ژن همجوشی BCR-ABL و افزایش تعداد سلول های خونی ، کروموزوم فیلادلفیا در آزمایشات معمول قابل تشخیص نیست. با این حال ، تاکتیک های درمان در این مورد همانند بیماران با کروموزوم فیلادلفیا قابل تشخیص است.
روشهای تحقیق تصویربرداری. برای ارزیابی اثر سرطان خون بر سایر قسمت های بدن تجویز می شوند. به عنوان مثال ، از توموگرافی رایانه ای و سونوگرافی گاهی اوقات برای مشاهده و اندازه اندازه طحال در بیماران مبتلا به سرطان خون استفاده می شود.
سرعت پیشرفت آن چقدر است؟
هیچ روش خاصی برای پیش بینی مدت زمان فاز مزمن و شروع بحران بلاست در CML ایجاد نشده است. با این حال ، رسم است که افزایش ناگهانی سطح لکوسیت ها ، هپاتوسپلنومگالی و افزایش درصد بلاست ها در مغز استخوان قرمز را از عوامل نامطلوب در نظر بگیرند. در مورد AML نیز همین طور است.
ویژگی های دوره و درمان در دسته های خاص بیماران
روند بیماری ، بسته به سن و جنسیت ، خیلی متفاوت نیست. تنها عاملی که باید مورد توجه قرار گیرد ، وزن و سن بیماران است ، زیرا این خصوصیات بر تجویز دوز داروها تأثیر می گذارد.
بارداری. در دوران بارداری ، تشخیص لوسمی میلوئیدی بسیار نادر است ، از هر 300000 مورد ، 1 مورد. علاوه بر این ، اگر درمان به موقع را شروع نکنید ، احتمال سقط خود به خود وجود دارد. علاوه بر این ، افزایش سطح سلولهای بلاست در خون می تواند باعث عقب ماندگی رشد داخل رحمی ، تحریک تولد زودرس یا منجر به مرگ جنین داخل رحمی شود.
علیرغم وجود سد خونساز که جنین را از اثر شیمی درمانی محافظت می کند ، ممکن است در مراحل اولیه ختم بارداری توصیه شود. اگر تشخیص در سه ماهه 2-3 انجام شود ، به عنوان یک قاعده ، بقیه دوران بارداری تحت عنوان شیمی درمانی انجام می شود. علاوه بر این ، در طی دوره شیمی درمانی باید از شیردهی خودداری شود.
رفتار
در درمان سرطان خون میلوئید ، همکاری چندین متخصص برای ایجاد روشهای درمانی مطلوب لازم است. از اهمیت ویژه ای برخوردار است که بیمار تحت نظارت یک متخصص انکولوژیک و / یا متخصص خون باشد.
گزینه های درمانی به عوامل مختلفی از جمله مرحله بیماری ، عوارض جانبی مورد انتظار ، اولویت بیمار و وضعیت عمومی بدن بستگی دارد.
درمان هدفمند. این نوعی درمان است که ژنهای سلولهای بدخیم ، پروتئینهای آنها و محیط بافت را که باعث رشد و بقای سرطان خون می شود ، هدف قرار می دهد. درمان هدفمند از رشد و گسترش سلول های بدخیم جلوگیری می کند در حالی که آسیب به بافت سالم را محدود می کند.
تجویز داروهای هدفمند در AML مستقیماً به ویژگی جهش در سلولهای بدخیم بستگی دارد. به عنوان مثال ، "Midostaurin" (Rydapt) برای بیماران با جهش ژن FLT3 (25-30٪ موارد) نشان داده شده است. Enasidenib (IDHIFA) برای افراد مبتلا به AML راجعه یا مقاوم به درمان با جهش IDH2 توصیه می شود.
در CML ، هدف برای مواد فعال آنزیم تیروزین کیناز BCR-ABL است. 5 داروی اصلی به نام بازدارنده های تیروزین کیناز (TKI) وجود دارد: ایماتینیب (گلیوک) ، داساتینیب (اسپریسل) ، نیلوتینیب (تاسیگنا) ، بوسوتینیب (بوسولیف) و پونتینیب (ایکلسیگ). هر 5 دارو می توانند آنزیم BCR-ABL را متوقف کنند و باعث مرگ سریع سلول های CML شوند.
توجه به این نکته مهم است که هنگام مصرف TKI ، زنان و مردان باید از باردار شدن کودک خودداری کنند. در غیر این صورت ، خطر سقط خود به خودی ، مرگ داخل رحمی جنین یا تولد کودکی با ناهنجاری های شدید وجود دارد. علاوه بر این ، بیماران ممکن است میلوفیبروز ایدیوپاتیک به عنوان یک عارضه جانبی CML درمانی ایجاد کنند.
شیمی درمانی داروهایی از این گروه برای از بین بردن سلولهای بدخیم با سرکوب توانایی رشد و تقسیم آنها تجویز می شود. شکل تجویز داروها می تواند به صورت تزریق داخل وریدی ، زیر جلدی یا به صورت قرص باشد. یک رژیم شیمی درمانی معمولاً شامل تعداد مشخصی از چرخه ها است که در یک بازه زمانی مشخص داده می شود. بیمار می تواند همزمان 1 دارو یا چند دارو مصرف کند.
این درمان اصلی برای AML است. به دلیل توسعه مکرر عوارض ، روند درمان بسیار دشوار است ، بنابراین دوره های شیمی درمانی باید بر اساس بیمارستان های تخصصی انجام شود. در درمان بیماران ، معمول است که 4 مرحله را تشخیص دهیم:
- القا rem بهبودی
- لنگر انداختن
- تشدید
- مراقبت های حمایتی (2-5 سال).
متداول ترین ترکیب مورد استفاده سیتارابین (Cytosar-U) و داروی آنترا سایکلین مانند Daunorubicin (Cerubidine) یا Idarubicin (idamycin) است. برخی از افراد مسن نمی توانند این داروها را مصرف کنند و به جای آن می توان از Dacogen ، Azacitidine (Vidaza) و / یا دوزهای پایین سیتارابین استفاده کرد.
به عنوان یک قاعده ، برای دستیابی به بهبودی ، 2-5 دوره شیمی درمانی لازم است ، پس از آن بیمار وارد مرحله تثبیت می شود و چندین روش دیگر برای وی تجویز می شود. درمان حمایتی تقریباً یک هفته پس از پایان دوره سخت شدن آغاز می شود. در صورت رعایت پروتکل های مدرن ، بهبودی پایدار در 60٪ و بهبودی در 30٪ بیماران حاصل می شود.

به عنوان یک قاعده ، در CML ، داروهای هیدروکسی اوره (دراکسیا ، هیدره) تجویز می شود که در کاهش تعداد لکوسیت ها خوب است. شیمی درمانی می تواند به شما کمک کند تا شمارش خون در طی چند روز یا چند هفته به حالت طبیعی خود بازگردد و در عین حال اندازه طحال را کاهش دهد. با این حال ، آماده سازی هیدروکسی اوره محتوای سلولهای دارای کروموزوم فیلادلفیا را کاهش نمی دهد و در مرحله بحران بلاست چنین اثر برجسته ای ندارد. علی رغم این واقعیت که هیدروکسی اوره عوارض جانبی کمی دارد ، اما به بیشتر بیماران مبتلا به CML که اخیراً تشخیص داده شده اند توصیه می شود Imatinib یا TKI دیگری مصرف کنند. این بدان معناست که بیماران نیازی به هیدروکسی اوره ندارند یا فقط برای مدت کوتاهی از آن استفاده می کنند.
پیوند سلول های بنیادی / مغز استخوان. این یک روش پزشکی است که در آن مغز استخوان بیمار با سلول های بنیادی خونساز از یک اهدا کننده سالم جایگزین می شود. این روش موثرترین روش درمانی برای هر دو نوع سرطان خون محسوب می شود. پیوند سلول های بنیادی به 2 نوع وجود دارد:
- آلوژنیک - پیوند از یک اهدا کننده سازگار (معمولاً از بستگان) ؛
- اتولوگ - پیوند مغز استخوان خود.
موفقیت پیوند تحت تأثیر مرحله بیماری ، نتایج درمان قبلی ، سن بیمار و شرایط عمومی است. اگرچه پیوند تنها روشی است که می تواند بهبودی کامل از CML را تضمین کند ، اما به دلیل خطر بالای عوارض جانبی ، کمتر از TKI استفاده می شود.

ایمونوتراپی این روش مکانیسم های دفاعی طبیعی بدن را افزایش می دهد تا آنها را برای مبارزه با سرطان خون میلوئید فعال کند. ایمنی درمانی شامل استفاده از داروهایی است که بر اساس اجزای ایمنی ساخته شده اند و در شرایط آزمایشگاهی یا طبیعی ساخته می شوند. "اینترفرون" (Alferon، Infergen، Intron A، Roferon-A) یک گروه موثر از داروها است که می تواند تعداد لکوسیت ها را کاهش دهد و در برخی موارد حتی تعداد سلول های حاوی کروموزوم فیلادلفیا را کاهش دهد.
قبل از در دسترس بودن ایماتینیب ، درمان با اینترفرون اصلی ترین درمان CML فاز مزمن بود. در حال حاضر ، اینترفرون به عنوان یک داروی خط اول توصیه نمی شود ، زیرا تعدادی از مطالعات نشان داده اند که TKI بهتر عمل می کند و عوارض جانبی کمتری ایجاد می کند. در عین حال ، برخلاف ITK ، مصرف "اینترفرون" در دوران بارداری بی خطر است.
درمان های جدید بیشتر مراکز عمده خون و سرطان به طور فعال در آزمایشات بالینی با هدف افزایش میزان بهبودی موفقیت آمیز از سرطان خون میلوئید نقش دارند. با مشورت با پزشک ، لازم است امکان شرکت در پروژه های تحقیقاتی برای به دست آوردن درمان تجربی روشن شود.
تکنیک های امیدوار کننده ای که در حال آزمایش هستند شامل موارد زیر است:
- ترکیبات "Imatinib" با داروهای دیگر ؛
- توسعه طرح های جدید برای استفاده از ITC.
- تولید واکسن علیه BCR-ABL ؛
- توسعه روشهای جدید پیوند سلولهای بنیادی با هدف کاهش عوارض جانبی.

درمان جایگزین. لوسمی های میلوئیدی بیماری های بسیار جدی هستند که با مرگ و میر زیاد و مشکلات زیادی در درمان مشخص می شوند. به همین دلیل ، استفاده از داروهای قومی برای بیمار بی اثر یا حتی مضر خواهد بود. در صورت تمایل ، بیماران می توانند از جوشانده های تهیه شده روی کدو تنبل ، بلوبری یا جوانه توس استفاده کنند ، اما فقط علاوه بر درمان اصلی.
توانبخشی
پروتکل ها برنامه توانبخشی خاصی را ارائه نمی دهند ، اما دوره های فیزیوتراپی ، حمام های درمانی ، اکسی تراپی ، حمایت روانشناختی و تغذیه متعادل را می توان برای بهبود وضعیت بیمار توصیه کرد. مهم است که بیمار در طول دوره توان بخشی تحت نظارت متخصصی باشد که شرایط بیمار را درک کند و بتواند عوارض جانبی درمان را از بین ببرد.
عود مجدد
در بیشتر موارد ، بیماران مبتلا به سرطان خون حاد میلوئیدی پس از شیمی درمانی دچار عود می شوند. در چنین مواردی ، پیوند سلول های بنیادی اتولوگ توصیه می شود. تعدادی از مراکز خون شناسی که در دومین بهبودی یا در ابتدای عود اول به این روش درمانی پایبند هستند ، در 25-50٪ موارد به بهبود بیماران می رسند.
چنین نتایج بالایی بدست آمد زیرا بسیاری از بیماران در اولین بهبودی سلولهای بنیادی خود را حفظ کرده و پس از آن پیوند موفقیت آمیز انجام دادند. برداشت سلول های بنیادی پس از عود به حدی موثر نیست که کمتر از نیمی از بیمارانی که شیمی درمانی می کنند ، به بهبودی دوم دست پیدا کنند. بهینه ترین راه حل برای بیمارانی که قبلاً سلولهای بنیادی حفظ نشده اند ، پیوند آلوژنیک است.
اگر بیمار فرصتی برای پیوند سلول های بنیادی نداشته باشد ، در چنین مواردی روش اصلی درمانی تعیین شیمی درمانی با دوز بالا خواهد بود.
جریان مقاوم در برابر
اکثر بیماران پس از درمان اولیه AML به بهبودی (بدون علائم و نشانه ها) می رسند. اما در بعضی از بیماران ، بخشهای کوچکی از سلولهای جهش یافته حتی بعد از دوره کامل شیمی درمانی در بدن باقی می مانند. با گذشت زمان ، تعداد سلولهای آسیب دیده افزایش می یابد تا زمانی که در آزمایشات پیدا شوند یا تا زمان بازگشت علائم. به این بیماری لوسمی مقاوم گفته می شود.
پس از پایان درمان ، پزشک باید اطلاعات شخصی در مورد خطر احتمالی ابتلا به سرطان خون میلوئیدی مقاوم را در اختیار بیمار قرار دهد.
عوارض
سرطان خون میلوئیدی عوارض زیادی دارد که هم در پس زمینه بیماری زمینه ای ایجاد می شود و هم در نتیجه مصرف داروهای شیمی درمانی. با این حال ، بیشترین نگرانی پزشکان ، به دلیل افزایش خطر مرگ و کاهش کیفیت زندگی ، سه مورد زیر است:
- به دلیل افزایش پاتولوژیک تعداد سلولهای بلاست نابالغ ، رشد طبیعی خون جابجا می شود ، که منجر به نقض مکانیسم های ایمنی بدن می شود.

- خون ریزی. در مقابل تغییرات پاتولوژیک در سیستم انعقاد خون ، افراد مبتلا به AML بیشتر مستعد خونریزی داخلی ناگهانی هستند.
- ناباروری بسیاری از داروهایی که برای درمان AML استفاده می شوند باعث عقیمی به عنوان یک عارضه جانبی می شوند. به طور معمول ، موقتی است اما در بعضی موارد می تواند دائمی نیز باشد.
پیش بینی (امید به زندگی)
در AML ، پیش آگهی با توجه به نوع سلولهای درگیر در روند آسیب شناسی ، سن بیمار و کفایت درمان تعیین می شود. تکنیک های درمانی مدرن و استاندارد ، بقا را در بیماران بزرگسال (تا 60 سال) افزایش می دهد ، اما این شاخص در بیماران مسن بسیار کمتر است.
امید به زندگی بیمارانی که از CML رنج می برند از 3.5 سال از تاریخ تشخیص فراتر نمی رود. مرحله بحران انفجار به ویژه برای زندگی خطرناک است. 85٪ از کل مرگ و میر ناشی از CML را تشکیل می دهد. درمان به موقع و مناسب به بیمار این امکان را می دهد تا از لحظه تشخیص بیماری بقای خود را به طور متوسط \u200b\u200b5-6 سال افزایش دهد.
رژیم غذایی
برای بیماران مبتلا به بیماری های خونی جدول شماره 11 تجویز می شود. تأکید در تغذیه باید بر روی گوشت ، تخم مرغ ، شیر ، پنیر و کفیر باشد. همچنین ، برای جبران مجدد از دست دادن ویتامین ها ، مصرف منظم سبزیجات و میوه ها ضروری است. مقدار کل کالری روزانه باید حداقل 4500 کیلوکالری باشد.

جلوگیری
هیچ پیشگیری خاصی برای سرطان خون میلوئید وجود ندارد. فقط می توان به افراد در معرض خطر توصیه کرد که تماس با بنزن ، آفت کش ها و عناصر رادیواکتیو را کنار بگذارند. یکی از اهداف پیشگیری از پیگیری پس از درمان ، بررسی منظم عود بیماری است. بنابراین ، توصیه می شود سالانه تحت معاینه پیشگیرانه قرار بگیرید ، که لزوماً شامل آزمایش خون عمومی است.
درمان سرطان خون میلوئیدی در اسرائیل
طبق آماری که در مورد درمان سرطان خون حاد میلوئیدی در اسرائیل وجود دارد ، در 90٪ موارد ، بیماران بهبودی پایدار پیدا می کنند و بیش از نیمی از آنها بهبودی کامل دارند.
در کلینیک های اسرائیل ، درمان بیماری های خون شناسی مبتنی بر فن آوری های پیشرفته پزشکی ، تجربه عملی گسترده متخصصان و پروتکل های مدرن است که بقای بیمار را افزایش می دهد.
آزمایش سرطان خون میلوئیدی در بخش های خون شناسی کلینیک ها یا مراکز پزشکی تخصصی انجام می شود. موارد تشخیصی شامل موارد زیر است:
- معاینه اولیه بیمار و جمع آوری اطلاعات در مورد تاریخچه بیماری ، پویایی پیشرفت و علائم آن.
- روش های تحقیق آزمایشگاهی ، از جمله هموگرام و آزمایش خون بیوشیمیایی. آزمایش سیتوژنتیک همچنین برای شناسایی تغییرات ژنتیکی و ارزیابی میکروسکوپی وضعیت کروموزوم ها در سلول های خون ، مغز استخوان و غدد لنفاوی انجام می شود.
- پنچری کمر شامل نمونه برداری از مغز استخوان و کمک به تشخیص سلولهای غیر طبیعی است. به عنوان یک قاعده ، حصار از ناحیه کمر تحت بی حسی موضعی با استفاده از یک سوزن مخصوص سوراخ ساخته می شود.
- نمونه برداری از مغز استخوان روش اصلی در تشخیص سرطان خون است. این تشخیص را تأیید می کند و نوع بیماری را تعیین می کند. پزشک بافت را تحت بی حسی موضعی جمع می کند ، یا در صورت تمایل بیمار ممکن است از آرام بخشی وریدی استفاده شود.
- سونوگرافی بزرگ شدن غدد لنفاوی در ناحیه شکم را نشان می دهد و همچنین امکان ارزیابی ساختار و اندازه کبد ، طحال و کلیه ها را فراهم می کند.
علاوه بر این استاندارد تشخیصی ، پزشک می تواند روش های تحقیقاتی دیگری را تجویز کند و همچنین برای مشاوره به متخصصان دیگر مراجعه کند.
از میان روشهای نوین درمانی در اسرائیل ، موارد زیر استفاده می شود:
- شیمی درمانی با هدف سرکوب رشد و تقسیم سلول های بدخیم انجام می شود. این روش مبتنی بر اصول افزایش کارایی و کاهش خطر عوارض جانبی است.
- روشی برای درمان مونوکلونال مبتنی بر استفاده از آنتی بادی های ویژه که به طور انتخابی به سلول های غیر معمولی حمله می کنند.
- پیوند سلول های بنیادی بنیادی ترین روش درمان است ، در بیشتر موارد امکان از بین بردن کامل بیماری را فراهم می کند.
- درمان هدفمند بر اساس اصل هدف قرار دادن مستقیم سلولهای بدخیم بدون آسیب رساندن به بافتهای سالم بدن.

رویکرد فردی به هر بیمار و استفاده از آخرین فن آوری ها اصول اصلی درمانی است که در کلینیک های اسرائیل استفاده می شود. چنین روشهایی می تواند به طور قابل توجهی شانس بهبودی بیمار را افزایش دهد و همچنین پیش آگهی کیفیت زندگی بیشتر را بهبود بخشد.
بهترین بیمارستان ها در اسرائیل
مرکز پزشکی "هرتزلیا". هماتولوژیست های باتجربه بیماران خود را برای درمان سرطان خون تضمین می کنند. بیمارستان خصوصی هرتزلیا بهترین موسسه پزشکی اسرائیل است که مراقبت های پزشکی درجه یک و بهترین استانداردهای درمانی را که می تواند در اختیار بیماران خود قرار دهد. درمان بیماریهای خون در مرکز پزشکی Herzliya بر اساس آخرین پیشرفتهای علمی است که به شما امکان می دهد در تمام مراحل بیماری به نتایج چشمگیری دست پیدا کنید و دقیق ترین استانداردهای ایمنی بیمار را داشته باشید. بیمارستان خصوصی مرکز پزشکی Herzliya همه شرایط را برای تشخیص و درمان هر سطح از پیچیدگی دارد.
متخصصان پروتکل های مدرن شیمی درمانی ، پیوند مغز استخوان و همچنین سایر روش های درمانی را به بیماران خود ارائه می دهند که به آنها امکان می دهد در درمان سرطان خون حداکثر نتایج را کسب کنند. هدف اصلی پزشکان بهبود میزان بقا و کیفیت زندگی بیماران است. در کلینیک Assuta ، بیماران براساس اطلاعات ژنتیکی در مورد نوع آسیب شناسی خون ، درمان فردی دریافت می کنند. این بیمارستان یک تیم متخصص دارد که به طور مداوم روش های جدید مبارزه با سرطان خون را آزمایش می کنند. این بدان معنی است که بیماران بیمارستان Assuta می توانند در آزمایشات بالینی پروتکل های درمانی جدید که در بیمارستان های دیگر در دسترس نیستند شرکت کنند.

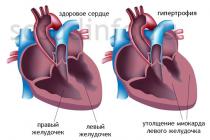
سرطان خون میلوئیدی مزمن (CML) یک بیماری مزمن میلوپرولیفراتیو است که در آن تشکیل گرانولوسیت ها افزایش می یابد (عمدتا نوتروفیل ها ، همچنین پرومیلوسیت ها ، سلول های میلوئیدی ، متامیلوسیت ها) ، که یک لایه تومور است. در بیشتر موارد ، نتیجه طبیعی بیماری یک بحران بلاست است که با ظهور تعداد زیادی سلول بلاست ، مقاومت در برابر درمان و پایان دادن به مرگ مشخص می شود.
علت شناسی و پاتوژنز. علت رشد غیرطبیعی سلول در نظر گرفته می شود جهش در سلول مولد میلوپوئیز (سلول توانمند تا حدی تعیین شده). این با تشخیص یک نشانگر خاص در بیماران CML - یک کروموزوم Ph آسیب شناس (فیلادلفیا) در سلول های میکروب های میلوئید ، اریتروئید ، یک سلول و پلاکت ثابت می شود. کروموزوم Ph یک مارکر سلولی مکرر است که منشا کل کلون سلول پاتولوژیک در CML را از یک مادر تأیید می کند. علیرغم این واقعیت که هر سه جوانه مغز استخوان سرطان خون هستند ، در مرحله گسترش یافته CML ، رشد نامحدود ، به عنوان یک قاعده ، از یک جوانه - گرانولوسیتیک مشاهده می شود. تولید مگاکاریوسیت ها به میزان قابل توجهی در مغز استخوان و پلاکت ها در خون محیطی افزایش می یابد.
با پیشرفت بیماری ، مرحله مونوکلونال با مرحله پلی کلونیک جایگزین می شود ، که با ظهور سلول هایی با مجموعه ای متفاوت از کروموزوم ها ثابت می شود. این مظهر قانون پیشرفت تومور است که از این سرطان خون تبعیت می کند.
CML بیشتر در بزرگسالان 30-70 ساله دیده می شود. کمی غلبه مردان وجود دارد. CML شایع ترین سرطان خون است ؛ 20٪ هموبلاستوزها را در بزرگسالان تشکیل می دهد.
طبقه بندی. همانطور که اشاره شد ، این بیماری به طور طبیعی دو مرحله از تکامل خود را طی می کند - مونوکلونال و پلی کلونال. این به دلیل سه مرحله لوسمی میلوئیدی مزمن در یک شرایط بالینی است.
مرحله I - اولیه - تکثیر میلوئیدی مغز استخوان + تغییرات جزئی در خون بدون مسمومیت (تا 1-3٪ بلاست ها در خون محیطی مشاهده می شود). ^ e
مرحله II - گسترش یافته - تظاهرات بالینی و خون شناسی مشخص (مسمومیت با محصولات پوسیدگی سلولهای لوسمیک ،
E کبد و طحال ، تکثیر میلوئیدی مغز استخوان + تغییر در I و I در خون). در خون محیطی ، تا 10٪ از بلاست ها. مرحله III - ترمینال (مربوط به توسعه تورم پلی کلونال است) - مقاوم به درمان مداوم سیتواستاتیک ، خستگی ، بزرگ شدن قابل توجه طحال و کبد ، تغییرات دیستروفی در اندام های داخلی ، تغییرات برجسته خون (کم خونی ، لومبوپیتوپنی). مرحله نهایی CML با توسعه مشخص می شود
من بحرانهای بلاست را نامیدم - ظهور سلولهای ygast در خون محیطی (تا 30-90) ، که در ارتباط با آن بیماری طیف وسیعی از لوسمی حاد را پیدا می کند. اغلب ، در مغز استخوان و خون محیطی ، CRIS استال با ظاهر میلوبلاست مشخص می شود ؛ با این حال ، سلولهای بلاست تمایز نیافته را نیز می توان یافت. یک مطالعه کاریولوژیکی ماهیت پلی کلونیک سلولهای پاتولوژیک را نشان می دهد. در همان زمان ، مهار قابل توجهی از ترومبوسیتوپوئیز وجود دارد ، سندرم خونریزی دهنده ایجاد می شود. همچنین یک نوع لنفوبلاستیک از بحران بلاست وجود دارد (تعداد زیادی لنفوبلاست در مغز استخوان و خون محیطی ظاهر می شوند).
تصویر بالینی تظاهرات بالینی CML را می توان در سندرم های بزرگ بیان کرد.
سندرم میلوپرولیفراتیو ، که مبتنی بر تکثیر میلوئید مغز استخوان است ، شامل موارد زیر است:
الف) علائم عمومی ناشی از مسمومیت ، تکثیر سلولهای لوسمیک در مغز استخوان ، طحال و کبد (تعریق ، ضعف ، کاهش وزن ، سنگینی و درد در طحال و کبد) ، اسالژی ؛
ب) بزرگ شدن کبد و طحال ؛
ج) نفوذ لوسمیک در پوست ؛
د) تغییرات مشخصه در مغز استخوان و خون محیطی. سندرم ناشی از عوارض:
الف) دیاتوز خونریزی دهنده (خونریزی و ترومبوز به دلیل اختلال در پروکواگولان و هموستاز پلاکت).
ب) التهاب چرکی (ذات الریه ، پلوریس ، برونشیت ، ضایعات چرکی پوست و چربی زیر جلدی) ، ناشی از کاهش شدید فعالیت سیستم ایمنی بدن ؛
ج) دیاتز اسید اوریک (هایپراوریسمی به دلیل افزایش تجزیه گرانولوسیت ها).
شدت متفاوت سندرم ها در مراحل مختلف بیماری ، یک تصویر بالینی نسبتاً چند شکل را تعیین می کند. مشاهده بیمارانی که شکایتی از خود نشان نمی دهند و کاملاً جسمی هستند و بیماران با ضایعات شدید اندام های داخلی ، خسته ، کاملاً ناتوان ، امکان پذیر است.
در اولین مرحله از جستجوی تشخیصی در مرحله اولیه بیماری ، بیماران ممکن است شکایتی نداشته باشند و بیماری در مراحل بعدی تشخیص داده می شود. شکایات از طبیعت عمومی (ضعف ، تعریق ، کاهش وزن بدن) می تواند با طیف گسترده ای از بیماری ها همراه باشد ، بنابراین در نظر گرفتن آنها در مرحله I به عنوان خاص CML غیرممکن است. فقط بعداً ، هنگامی که علائم دیگری که نشانگر CML هستند ، می توانند به عنوان بیان هم افزایی میلوپرولیفراتیو تفسیر شوند.
شدت و درد در هیپوکندری چپ و راست معمولاً با بزرگ شدن طحال و کبد توضیح داده می شود. همراه با شکایات عمومی Pj * KTepa و درد استخوان ، آنها می توانند پزشک را به سمت بیماری میلوفوئید هدایت کنند.
در مرحله نهایی بیماری ، بخشی از شکایات ممکن است به دلیل بروز عوارض باشد: چرکی - التهابی ، دیاتز خونریزی دهنده ، دیاتز اسید اوریک. r °
در مرحله اول ، می توانید در مورد تغییرات در هموگرام و درمان قبلی (داروهای سیتواستاتیک) اطلاعات کسب کنید. در نتیجه ، "اگر بیماری که قبلاً با CML تشخیص داده شده است از نظر پزشک باشد ، جستجوی تشخیصی بعدی بسیار ساده می شود. اما برای آگاهی از اطلاعات مربوط به درمان و بی اثر بودن داروها در بیماران ، که تا این مرحله وضعیت عمومی کاهش تعداد لکوسیت ها را بهبود می بخشد. چنین اطلاعاتی به ما امکان می دهد انتقال به مرحله پلی کلونال (ترمینال) بیماری را فرض کنیم.
در مرحله دوم جستجوی تشخیصی ، می توان اطلاعاتی را به دست آورد که فرض را ممکن می سازد: 1) در مورد ماهیت روند آسیب شناختی ، به عنوان مثال جوهر خود بیماری ؛ 2) در مورد مرحله بیماری ؛ 3) در مورد عوارض احتمالی.
در مراحل منبسط شده و ترمینال ، علائمی آشکار می شود که به طور قابل توجهی فرض CML را تأیید می کند: رنگ پریدگی پوست (به دلیل افزایش کم خونی) ، خونریزی های پوستی و نفوذ (بیشتر برای مرحله نهایی CML). یک علامت قابل توجه ، اسپلنومگالی است (بدون بزرگ شدن غدد لنفاوی) ، همراه با بزرگ شدن کبد ، که با شکایت مناسب و آنامز ، می تواند به عنوان مظهر سندرم میلوپرولیفراتیو در نظر گرفته شود.
با ایجاد عوارض ، به عنوان مثال ، انفارکتوس طحال ، احساس لرزشی شدید ، صدای مالش صفاق روی طحال وجود دارد. به تدریج ، طحال متراکم می شود (وزن آن 6-9 کیلوگرم است ، با قطب پایین به لگن کوچک پایین می آید).
مهمترین داده ها برای تشخیص CML در مرحله III جستجوی تشخیصی بدست می آید.
در مرحله I بیماری ، لکوسیتوز در خون محیطی (بیش از 50 109 در لیتر با نوتروفیل (گرانول سلولهای تمام مراحل بلوغ - سلولهای میلوس ، جوان ، چاقو) ، ائوزینوفیل - بازوفیل) تشخیص داده می شود. تعداد پلاکت ها تغییر نمی کند (گاهی اوقات کمی افزایش می یابد). گاهی اوقات مقدار کمی تعداد بلاست ها - تا 1-3٪. مغز استخوان غنی از عناصر سلولی با غلبه عناصر سری گرانولوسیتی است. تعداد ائوزینوفیل ها ، بازوفیل ها ، گرانولوسیت ها را می توان افزایش داد.
در مرحله II ، تعداد لکوسیت ها 50-500 109 در لیتر است ، محتوای اشکال نابالغ افزایش می یابد (پرومیلوسیت ها 20-30 are است) ، بلاست ها تا 10، ، پلاکت ها کاهش یا افزایش می یابد. در مغز استخوان چند سلولی مشخص وجود دارد ، در لکوگرام انتقال به سمت چپ به شدت بیان می شود ، محتوای پرومیلوسیت ها افزایش می یابد ، بلاست ها - حدود 10٪
در مرحله III ، تعداد لکوسیت ها کم است (حداکثر 50109 در لیتر) ، بسیاری از اشکال نابالغ وجود دارد ، بلاست ها بیش از 10٪ هستند ، در میان آنها اشکال زشت وجود دارد. تعداد پلاکت کاهش می یابد. در مغز استخوان ، محتوای بلاست افزایش می یابد ، گلبول قرمز و ترومبوسیتوپوئیز مهار می شوند.
خصوصیات عملکردی لکوسیت ها و محتوای آنزیم ها در آنها تغییر می کند: فعالیت آلکالن فسفاتاز نوتروفیل ها کاهش می یابد ، توانایی فاگوسیتوز افزایش می یابد. سوراخ شدن طحال در مرحله پیشرفته بیماری ، غلبه سلول های میلوئیدی را نشان می دهد (که هرگز طبیعی نیست). هفتم
این مرحله برای شناسایی P _ بلاست تعیین کننده است: افزایش تعداد سلولهای بلاست در مغز استخوان و محیط پیرامونی
خون 0 (تعداد کل بلاست ها و پرومیلوسیت ها 20٪ c1C است؟ Llee ، در حالی که خارج از بحران انفجار این مقدار معمولاً از 10-15٪ تجاوز نمی کند) -
سینتیگرافی استخوان به تشخیص افزایش پل خون کمک می کند (این مطالعه با تشخیص نامشخص انجام می شود ؛ برای همه بیماران مبتلا به CML اجباری نیست).
عیب یابی تشخیص CML در مرحله پیشرفته بیماری مشکلی ایجاد نمی کند و براساس اطلاعات مشخص آزمایش خون ، سونوگرافی مغز استخوان ، بزرگ شدن کبد و طحال است. ^ معیارهای تشخیصی بیماری عبارتند از: لکوسیتوز بیش از 20-109 در لیتر ؛
ظهور فرمول لکوسیت ها در فرم های تکثیر (میلوبلاست ها و پرومیلوسیت ها) و گرانولوسیت های بالغ (میلوسیت ها ، من-
سلولهای تمیل)
تکثیر میلوئیدی مغز استخوان (طبق میلوگرام
و ترپانوبیوپسی) ؛
کاهش فعالیت آلکالن فسفاتاز نوتروفیل ها (کمتر
تشخیص Ph-chromosome در سلولهای خونساز.
گسترش "سکوی پرشی" خون سازی (طبق نقشه برداری)
افزایش اندازه طحال و کبد. تشخیص افتراقی. CML باید با این تفاوت باشد
واکنش های لوسموئید ، که می تواند در تعدادی از بیماری ها (سل ، سرطان ، عفونت های مختلف ، نارسایی کلیه و غیره) رخ دهد. به گفته A.I. Vorobiev ، یک واکنش لکوموئید "تغییراتی در خون و اندام های خونساز ، یادآور لوسمی و سایر تومورهای سیستم خونساز است ، اما به توموری شبیه نمی شود". با واکنش لوکوموئید ، یک لکوسیتوز بالا مشاهده می شود ، نوتروفیل های نابالغ در خون محیطی ظاهر می شوند ، اما ارتباط بازوفیل - ائوزینوفیل تشخیص داده نمی شود. تشخیص افتراقی براساس شناسایی بیماری زمینه ای (سرطان ، سل و غیره) و همچنین افزایش فعالیت آلکالن فسفاتاز نوتروفیل ها (به جای کاهش آن در CML) است. با سوراخ شدن جناغ ، واکنش لوسموئید با افزایش محتوای میلوسیت مشخص می شود ، اما کروموزوم Ph هرگز شناسایی نمی شود.
رفتار. وظیفه اصلی درمان هر نوع هموبلاستوز (از جمله CML) حذف یا سرکوب رشد یک کلون پاتولوژیک سلول است. با این حال ، در رابطه با سرطان خون مزمن ، این بدان معنا نیست که هر بیمار مبتلا به بیماری سیستم خون باید بلافاصله تحت درمان با داروهای سیتواستاتیک قرار گیرد که رشد تومور را سرکوب می کنند.
در مرحله اولیه بیماری (با سلامتی خوب ، اما تغییرات بدون شک در خون محیطی و مغز استخوان) ، درمان تقویت کننده عمومی ، تغذیه مناسب ، رعایت رژیم لازم است
سنگ معدن و استراحت (جلوگیری از قرار گرفتن در معرض آفتاب بسیار مهم است). بیمار باید تحت نظارت پزشکی باشد. به طور دوره ای (هر 3-6 ماه یکبار) بررسی خون محیطی ضروری است.
هنگامی که علائم پیشرفت بیماری ظاهر می شود ، انجام سیتوستاتیک درمانی ضروری است و میزان چنین درمانی به مرحله بیماری بستگی دارد. هنگامی که علائم متمایز رشد تومور ظاهر می شود (افزایش اندازه طحال ، کبد ، و همچنین افزایش در
تعداد لکوسیت ها در مقایسه با دوره قبلی botno) به اصطلاح درمان مهاری اولیه را انجام می دهند. درمان معمول وقتی شروع می شود که تعداد لکوسیت ها 50-70-109 در لیتر باشد. Ambulatop ° از هیدروکسی اوره (هیدره) در دوزهای پایین (با کنترل خونشناسی اجباری) استفاده کنید. پس از رسیدن به بهبودی بالینی و / و خون ، در مورد موضوع درمان نگهدارنده تصمیم گیری می شود
در مرحله پیشرفته بیماری ، میزان شیمی درمانی به "گروه خطر" بستگی دارد ، که با وجود علائم نامطلوب تعیین می شود - ° T
1) لکوسیتوز بیش از 200109 در لیتر ، بلاست بیش از 3، ، مقدار بلاست و میلوسیت nn0 در خون بیش از 20، ، تعداد بازوفیل در خون بیش از 10 ""
2) کاهش هموگلوبین به کمتر از 90 گرم در لیتر.
3) ترومبوسیتوز بیش از 500 109 در لیتر یا ترومبوسیتوپنی کمتر از 100 109 در لیتر -
4) طحال (طحال 10 سانتی متر زیر قوس ساحلی یا بیشتر قابل لمس است) ؛
5) هپاتومگالی (کبد 5 سانتی متر زیر قوس پائین یا بیشتر قابل لمس است).
کم خطر - وجود یک علامت ؛ خطر متوسط \u200b\u200b- وجود 2-3 علامت ؛ پرخطر - وجود 4 علامت یا بیشتر. در معرض خطر کم و متوسط \u200b\u200b، در ابتدا تک شیمی درمانی نشان داده می شود ؛ در معرض خطر ، از همان ابتدا پلی شیمی درمانی توصیه می شود.
در مرحله گسترش یافته ، یک دوره شیمی درمانی انجام می شود. از Hydrea استفاده می شود ، اما در دوزهای بزرگ (2-3 دوز روزانه) تحت کنترل خون شناسی: با کاهش تعداد لکوسیت ها و پلاکت ها ، دوز دارو کاهش می یابد و اگر محتوای لکوسیت ها 10-20 109 در لیتر باشد و پلاکت ها 100-109 در لیتر باشد ، دارو لغو می شود. اگر داروهای قبلاً مثر طی 3-4 هفته تأثیری نداشته باشند ، باید دوره درمانی با سیتواستاتیک دیگر انجام شود. بنابراین ، اگر هیدره بی اثر باشد ، میلوسان (بوسولفان ، میلر) ، میلوبرومول تجویز می شود.
پس از یک دوره شیمی درمانی ، درمان حمایتی مطابق با یک طرح نزدیک به طرح بازدارندگی اولیه انجام می شود. آنها از داروهایی استفاده می کنند که در طول دوره شیمی درمانی اثر درمانی دارند.
پلی کیموتراپی در دوره هایی با درجه ریسک بالا و همچنین در مرحله پایانی CML انجام می شود. در یک بحران انفجار - به مقدار مربوط به درمان در OL. آنها از داروهایی استفاده می کنند که اثر سیتواستاتیک بر عناصر تکثیر یافته (سیتوزار ، متوترکسات ، وین کریستین ، آنتی بیوتیک ضد تومور روبومایسین هیدروکلراید) دارند. دوره های پلی شیمی درمانی کوتاه هستند (5-14 روز با فواصل 7-10 روزه).
در حال حاضر ، روشهای اساسی جدیدی برای درمان CML ظاهر شده اند - سیتوکین a-interferon (a-IFN). واقعیت این است که در روند تکثیر میلوئید ، مگاکاریوسیت ها و پلاکت ها تعداد زیادی از فاکتورهای رشد را ترشح می کنند ، که خود به تکثیر بیشتر سلول های بنیادی قدرتمند جهش یافته و سلول های بنیادی قدرتمند و علاوه بر این ، سلول های استرومایی کمک می کند. همه اینها منجر به پیشرفت بیشتر بیماری و همچنین ایجاد فیبروز و تغییرات در مغز استخوان می شود. در همین حال ، ثابت شده است که a-IFN از نظر ساختار شیمیایی و خصوصیات عملکردی آنتاگونیست فاکتورهای رشد است. این ماده موادی را ترشح می کند که از اثر تحریک کننده مگاکاریوسیت ها در خونسازی جلوگیری می کنند و در رابطه با سلولهای مادر خون دارای فعالیت ضد تکثیری هستند. علاوه بر این ، a-IFN ایمنی ضد تومور را تحریک می کند ^ بنابراین ، شرایطی برای حفظ خون طبیعی ایجاد می شود
Ia ، در حالی که a-IFN اثر سیتواستاتیک ندارد ، که یک خاصیت بسیار جذاب است ، زیرا هیچ اثر افسردگی بر سلولهای طبیعی مغز استخوان وجود ندارد. H ° در عمل ، از a-IFN - reaferon نوترکیب استفاده می شود ، یا
Tpon "A" ، که به صورت عضلانی یا زیر جلدی در دوز dH2 تا 9 MI / m2 در روز تزریق می شود (طبق گفته نویسندگان مختلف) به مدت 2-6 ماه / f MI \u003d 1 ° 00 °° 0 ED) "اجازه می دهد تا به رمس خون برسد -
و بسیاری از بیماران هنگام درمان با این دارو ، ممکن است یک سندرم "مانند نوع" ظاهر شود - تب ، سردرد ، تنش عضلانی ، سلامت عمومی ، اما مصرف پاراستامول این پدیده ها را خنثی می کند.
اینترون "A" گاهی اوقات با یک داروی سیتواستاتیک - هیدره یا سیتوزین-آرابینوزید (سیتوزار) ترکیب می شود ، که نتایج درمان را بهبود می بخشد. میزان بقای 5 ساله در درمان با اینترون "A" 32-89 ماه است (در 50٪ بیماران) ، در حالی که در درمان میلوزان این شاخص 44-44 ماه است.
بسیار مهم است که در طول درمان a-IFN ، هنگامی که کروموزوم Ph در سلولهای مغز استخوان و خون تشخیص داده نشود ، نه تنها از نظر خون ، بلکه بهبودی سیتوژنتیک نیز ممکن است رخ دهد ، که به ما امکان می دهد نه در مورد بهبودی بلکه در مورد بهبود کامل از
در حال حاضر ، "رویداد" اصلی در درمان CML یک داروی جدید است - مسدود کننده جهش تیروزین کیناز (پروتئین p210) - glivec (STI-571). این دارو با دوز 400 میلی گرم در متر مربع به مدت 28 روز تجویز می شود. در یک بحران انفجاری CML ، دوز 600 میلی گرم در روز (مترمربع در روز) است. استفاده از دارو منجر به بهبود کامل بیماری بدون ریشه کن سازی کلون تومور می شود. Glivec در حال حاضر داروی انتخابی برای CML است.
با افزایش قابل توجه طحال ، گاهی اوقات با اشعه X تحت تابش قرار می گیرد ، که منجر به کاهش اندازه آن می شود.
با عوارض چرکی-التهابی ، آنتی بیوتیک درمانی انجام می شود.
انتقال خون در CML برای سندرم کم خونی شدید که قابل درمان با سیتوستاتیک نیست ، یا درمان با داروهای آهن در صورت کمبود آهن نشان داده شده است. بیماران مبتلا به CML در پرونده های دارویی قرار می گیرند و معاینات دوره ای با کنترل خونشناسی اجباری انجام می شود.
پیش بینی. امید به زندگی بیماران مبتلا به CML به طور متوسط \u200b\u200b3-5 سال است ، در بعضی از بیماران به 7-8 سال می رسد. امید به زندگی پس از بحران انفجار به ندرت از 12 ماه فراتر می رود. استفاده از Intran A به طور قابل توجهی پیش آگهی بیماری را به سمت بهتر تغییر می دهد.
جلوگیری. هیچ اقدامی برای جلوگیری از CML وجود ندارد و بنابراین ما فقط می توانیم در مورد پیشگیری ثانویه از بیماری صحبت کنیم ، که شامل جلوگیری از تشدید بیماری است (درمان حمایتی ، حذف نور خورشید ، سرماخوردگی و غیره).
اریترامی (پلی سیتمی ورا ، بیماری واکز)
اریترامی (ER) یک بیماری میلوپرولیفراتیو ، مزمن است
سرطان خون فعلی خوش خیم ، که در آن وجود دارد
افزایش تشکیل گلبول های قرمز ، و همچنین لکوسیت های نوتروفیل
تخم مرغ و پلاکت. منبع رشد تومور یک سلول پیش ساز است
Ca myelopoiesis.
بروز اریترمی در حدود 6/0 در هر 10000 نفر جمعیت است. زنان و مردان هر دو به طور مساوی اغلب بیمار هستند. اریترامی یک بیماری در افراد مسن است: متوسط \u200b\u200bسن افراد مبتلا 60-55 سال است ، اما بیماری در هر سنی امکان پذیر است.
علت شناسی دلایل پیشرفت بیماری ناشناخته است.
بیماری زایی اریترامی بر اساس تکثیر کلونال تومور هر سه میکروب خونساز - قرمز ، گرانولوسیت و مگاکاریوسیت است ، اما رشد میکروب قرمز غالب است. در این راستا ، بستر اصلی تومور گلبول قرمز است که بیش از حد بالغ می شود. کانون های هموپوئید میلوئیدی در طحال و کبد ظاهر می شود (که هرگز طبیعی نیست). افزایش تعداد گلبول های قرمز و پلاکت ها در خون محیطی میزان جریان خون را کاهش می دهد ، ویسکوزیته و لخته شدن خون را افزایش می دهد ، که باعث ایجاد تعدادی از علائم بالینی می شود.
طبقه بندی. مرحله سیر بیماری ، درگیری طحال در روند آسیب شناسی و تبدیل بعدی اریترمی به سایر بیماری های سیستم خون در نظر گرفته می شود.
مرحله I - اولیه: محتوای هموگلوبین در حد بالای نرمال ، کمی افزایش در جرم گلبول های قرمز خون در گردش خون ، طحال کمی بزرگ شده است (به دلیل سرریز شدن از خون) یا عدم تغییر. فشار خون طبیعی یا کمی افزایش یافته است ، هیپرپلازی کانونی مغز استخوان در ترپانات از ایلیوم وجود دارد. مدت زمان مرحله من می تواند بیش از 5 سال باشد.
مرحله II - گسترش یافته: فاز A - بدون متاپلازی میلوئیدی طحال (نوع ساده پلوترا بدون طحال). هیپرپلازی کل مغز استخوان سه پا. عدم شعر همو شعله خارج از حفره؛ فاز B - با متاپلازی میلوئید طحال. سندرم میلوپرولیفراتیو بزرگ: پانسیوتوز در خون محیطی ، در مغز استخوان پانمیلوزیس با یا بدون میلوفیبروز کانونی ، متاپلازی میلوئید طحال با یا بدون فیبروز وجود دارد.
مرحله III - ترمینال: تخریب تومور خوش خیم به یک تومور بدخیم (میلوفیبروز همراه با کم خونی ، لوسمی میلوئید مزمن ، لوسمی حاد). میلوفیبروز تقریباً در تمام بیماران بیش از 10-15 سال ایجاد می شود. این روند طبیعی بیماری را منعکس می کند. نشانه ای از میلوفیبروز سیتوپنی است (کم خونی ، ترومبوسیتوپنی ، کمتر لکوپنی). توسعه لوسمی میلوئیدی مزمن با افزایش لکوسیتوز ، افزایش (یا شکل ظاهری) خون محیطی میلوسیت ها ، پرومیلوسیت ها و تشخیص کروموزوم Ph در سلول های خون و مغز استخوان آشکار می شود.
سرطان خون حاد معمولاً در بیمارانی که تحت درمان با سیتواستاتیک و فسفر رادیواکتیو هستند ، ایجاد می شود.
کم خونی در بیماران مبتلا به گلبول قرمز ممکن است با خونریزی مکرر ، افزایش رسوب گلبول های قرمز و همچنین همولیز آنها همراه باشد.
تصویر بالینی اریترمیا در دو سندرم عمده خود را نشان می دهد.
سندرم پلتریک به دلیل افزایش محتوای گلبول های قرمز ، و همچنین لکوسیت ها و پلاکت ها (پلوترا - پلتور) ایجاد می شود. این سندرم به دلیل: 1) ظهور علائم ذهنی است. 2) اختلالات سیستم قلبی عروقی ؛ 3) تغییر در پارامترهای آزمایشگاهی.
1. علائم ذهنی سندرم پلیتریک شامل سردرد ، سرگیجه ، تاری دید ، آنژین سینه ، خارش ، اریترومالالژیا (شروع ناگهانی پرخونی با
سایه کسل کننده پوست انگشتان ، همراه با درد شدید و سوزش) ، احساس بی حسی و خنکی اندام ممکن است.
2. اختلالات سیستم قلبی عروقی در تغییر در رنگ پوست و غشاهای مخاطی قابل مشاهده از نوع اریتروسیزانوز ، ویژگی های رنگ غشای مخاطی در انتقال کام نرم به کام سخت (علائم کوپرمن) ، فشار خون بالا ، ایجاد ترومبوز ، کمتر خونریزی دیده می شود. علاوه بر ترومبوز ، ادم پاها و اریترومالالژی نیز ممکن است. اختلالات گردش خون در سیستم شریانی می تواند منجر به عوارض شدید شود: سکته قلبی حاد ، سکته های مغزی ، اختلال بینایی ، ترومبوز شریان کلیوی.
3. تغییر در پارامترهای آزمایشگاهی: افزایش محتوای هموگلوبین و گلبول های قرمز ، افزایش هماتوکریت-تا و ویسکوزیته خون ، لکوسیتوز متوسط \u200b\u200bبا تغییر در فرمول لکوسیت ها به سمت چپ ، ترومبوسیتوز ، کاهش شدید ESR.
سندرم میلوپرولیفراتیو به دلیل هیپرپلازی هر سه رشد خونساز در مغز استخوان و خارج از بینی ایجاد می شود. شامل: 1) علائم ذهنی ، 2) اسپلنومگالی و (یا) هپاتومگالی ، 3) تغییر در پارامترهای آزمایشگاهی.
1. علائم ذهنی: ضعف ، تعریق ، تب ، درد استخوان ، سنگینی یا درد در هیپوکندری چپ (به دلیل
اسپلنومگالی).
2. اسپلنومگالی نه تنها با متاپلازی میلوئیدی اندام (ظاهر کانونهای خونسازى خارج از حفره) بلکه با رکود خون نیز توضیح داده می شود. بزرگ شدن کبد کمتر دیده می شود.
3. در میان شاخص های آزمایشگاهی ، انحراف از هنجار فیزیولوژیکی در خون محیطی بیشترین ارزش تشخیصی را دارد: پانسیوتوز ، اغلب با تغییر فرمول لکوسیت ها به سمت چپ ؛ با trep-nobiopsy ، هیپرپلازی سه رشد مغز استخوان ، در سوراخ شدن طحال - کانون های متاپلازی میلوئید ارگان ، مشخص می شود.
شدت متفاوت سندرم ها در مراحل مختلف بیماری منجر به تنوع شدید تصویر بالینی می شود. مشاهده بیماران با اریترامی بدون شک ، تقریباً بدون شکایت و جسمی کاملاً مناسب و بیمارانی که آسیب جدی به اندام های داخلی دارند و نیاز به درمان دارند و توانایی کار خود را از دست داده اند ، امکان پذیر است.
در اولین مرحله از جستجوی تشخیصی در مرحله اولیه بیماری ، بیماران ممکن است شکایتی نداشته باشند. با پیشرفت بیماری ، شکایات با حضور و شدت پلوتورا و روند میلوپرولیفراتیو همراه است. شایع ترین شکایات از نوع "فلج" ناشی از افزایش خونریزی رگهای خونی و اختلالات عصبی عروقی عملکردی (سردرد ، اریترومالالژی ، اختلال بینایی و غیره) است. تمام این علائم می تواند با بیماری های دیگر همراه باشد ، که باید در معاینه بیشتر بیمار روشن شود.
شکایات ناشی از وجود سندرم میلوپرولیفراتیو (تعریق ، سنگینی در هیپوکندری چپ ، درد استخوان ، تب) نیز برای اریترامی غیر اختصاصی است. خارش کاملاً مشخص است که پس از انجام روش های آب ظاهر می شود. این علامت در 55٪ بیماران در مرحله پیشرفته مشاهده می شود و با تولید بیش از حد بازوفیل و هیستامینمی توضیح داده می شود. ماهیت کهیر در 5-7٪ بیماران مشاهده می شود.
علائم ذکر شده برای تعیین مرحله اریترمی مهم است: آنها معمولاً انتقال بیماری به جزئیات را نشان می دهند
یا مرحله ترمینال با ایجاد میلوفیبروز به عنوان شایعترین نتیجه اریترامی.
در تاریخچه بیماران ، ممکن است عوارض بیماری مانند سکته مغزی ، سکته قلبی وجود داشته باشد. گاهی اوقات بیماری با این عوارض آغاز می شود ، و علت واقعی رشد آنها - اریترمی - در هنگام معاینه بیمار از نظر سکته یا انفارکتوس میوکارد مشخص می شود
علائم درمان قبلی با فسفر رادیواکتیو ، سیتواستاتیک یا خونریزی ممکن است وجود برخی از اختلالات خون نئوپلاستیک را نشان دهد. کاهش علائم سندرم پلوتوریک در طول درمان با این عوامل ، گلبول قرمز را نشان می دهد.
در مرحله II جستجوی تشخیصی ، شناسایی علائم متمایز فقط در مرحله II (گسترش یافته) بیماری امکان پذیر است. آنها عمدتا علائم سندرم پلیتریک را نشان می دهند: اریتروسیانوز ، عروق تزریق شده در ملتحمه ("چشم خرگوش") ، یک مرز رنگ مشخص در انتقال از کام سخت به کام نرم. علائم اریترو ملالژی را می توان تشخیص داد: تورم نوک انگشتان ، پا ، یک سوم پایین ساق پا ، همراه با پرخونی موضعی و احساس سوزش شدید.
هنگام بررسی سیستم قلبی عروقی ، فشار خون و بزرگ شدن بطن چپ در مرحله پیشرفته بیماری - "پاهای متنوع" (تغییر رنگ پوست پاها ، عمدتاً در قسمت دیستال) به شکل نواحی رنگدانه ای با شدت متفاوت به دلیل اختلال در گردش خون وریدی ، تشخیص داده می شود.
با لمس شکم ، می توان طحال بزرگ شده ای را تشخیص داد که یکی از علائم مشخصه بیماری است. بزرگ شدن طحال ممکن است به دلیل موارد زیر باشد: 1) افزایش رسوب عناصر خون. 2) هایپرتروفی "کار" به دلیل افزایش عملکرد تعیین کننده آن ؛ 3) خونسازي خارج از حفره خارجي (متاپلازي ميلوئيد با غلبه گلبول قرمز). این دلایل اغلب با هم ترکیب می شوند. بزرگ شدن کبد به دلایل مشابه و همچنین ایجاد فیبروز و هپاتیت واکنش غیر اختصاصی است. باید در نظر داشت که هپاتومگالی را می توان با تومور بدخیم کبدی با ایجاد گلبول قرمز ثانویه مشاهده کرد.
عوارض اریترامی به شکل ترومبوز مغزی با تعدادی از علائم کانونی مشخص شده در طول مطالعه بیان می شود
با این حال ، حتی در مرحله II نیز تشخیص قطعی اریترامی غیرممکن است ، زیرا بسیاری از علائم آن می تواند همراه با گلبول قرمز باشد. علاوه بر این ، علائمی مانند فشار خون ، اسپلنومگالی و هپاتومگالی در طیف گسترده ای از بیماری ها شایع است.
در این راستا ، مرحله III جستجوی تشخیصی از اهمیت تعیین کننده برخوردار است ، زیرا اجازه می دهد: الف) تشخیص نهایی ؛ ب) مرحله اریترمی را روشن کنید ؛ ج) شناسایی عوارض ؛ د) نظارت بر درمان.
تجزیه و تحلیل خون محیطی گلبول قرمز ، افزایش محتوای هموگلوبین و هماتوکریت را نشان می دهد ، که البته در اریتروسیتوز علامتی نیز رخ می دهد. افزایش سطح هموگلوبین در ترکیب با گلبول قرمز ، لکوسیتوز و ترومبوسیتوز از نظر تشخیصی ارزش دارد. در مطالعه فرمول لکوسیت ها ، تغییر شکل به سمت چپ به شکل نابالغ گرانولوسیت ها پیدا می شود. اگر تغییرات در خون محیطی ناچیز باشد یا داده ها غیرقطعی باشند (به عنوان مثال اریتروسیتوز با ترومبوسیتوز ترکیب نشده است) ، باید معاینه مغز استخوان (ترپانوبیوپسی) انجام شود. حضور در ترپانات کل -442
هیپرپلازی سه رشد لوی مغز استخوان با غلبه عناصر اشکال - Hbix در اریتروپوئز ، جایگزینی بافت چربی با جوانه مغز استخوان قرمز ، امکان تشخیص نهایی وجود دارد. انبساط "سر پل" خون سازي نيز با اسکن راديوکليد استخوان ها با 32P تشخيص داده مي شود. مطالعه هیستوشیمیایی نشان دهنده افزایش فعالیت آلکالن فسفاتاز نوتروفیل ها است.
عوارض دوره اریترمی با: 1) ترومبوز عروقی (عروق مغزی ، کرونر ، محیطی) پیچیده است. 2) سندرم خونریزی دهنده: خونریزی پس از مداخلات جراحی جزئی (کشیدن دندان) ، از عروق دستگاه گوارش ، بواسیر ، که به دلیل جمع شدن ضعیف لخته خون به دلیل تغییر در ویژگی های عملکردی پلاکت ها است. 3) اوریسمی درون زا و اوریکوزوریا (به دلیل افزایش مرگ سلولی در مراحل هسته ای بلوغ آنها) ، که با علائم ورم سنگ و آرتروز نقرس آشکار می شود.
نتایج بیماری شرایطی است که در مرحله III دوره بیماری نشان داده شده است (میلوفیبروز ، لوسمی میلوئیدی مزمن ، لوسمی حاد ، کم خونی).
عیب یابی اریترامی را می توان در افراد مبتلا به اریتروسیتوز مداوم همراه با لکوسیتوز نوتروفیل ، ترومبوسیتوز در غیاب بیماری ها (یا شرایط) مشکوک به اریتروسیتوز دانست.
معیارهای تشخیصی اریترامی (در مرحله گسترش یافته) عبارتند از:
افزایش توده گلبول های قرمز در گردش.
اشباع طبیعی خون شریانی با اکسیژن (بیش از 92٪).
لکوسیتوز بیش از 12109 در لیتر (در صورت عدم وجود دلایل واضح برای ظهور لکوسیتوز).
ترومبوسیتوز بیش از 400-109 در لیتر.
افزایش محتوای آلکالن فسفاتاز نوتروفیل ها (در صورت عدم وجود عفونت).
افزایش ظرفیت اتصال اشباع نشده ویتامین B12 سرم خون.
اگر سه علامت از گروه A یا دو علامت از رده A و یک علامت از رده B وجود داشته باشد ، تشخیص ER قابل اعتماد است.
مشکلات در تشخیص به دلیل وجود گلبول قرمز به اصطلاح علامتی در تعدادی از بیماری ها است. گلبول قرمز مطلق و نسبی را اختصاص دهید. با گلبول قرمز مطلق ، افزایش توده گلبول های قرمز در گردش و افزایش گلبول قرمز مشاهده می شود. برای اریتروسیتوز نسبی ، کاهش حجم پلاسمای در گردش و توده طبیعی گلبول های قرمز در گردش مشخص است. اریتروسیتوز نسبی اغلب در مردان مبتلا به فشار خون بالا ، چاقی ، نوراستنی ، دیورتیک مصرف می شود. گلبول قرمز مطلق ثانویه در افراد سیگاری ایجاد می شود ، این امر به دلیل افزایش محتوای مونوکسیدکربن در خون ایجاد می شود.
دلایل توسعه اریتروسیتوز علامتی: 1) هیپوکسی بافت کلی (آسیب شناسی ریوی ، بیماری قلبی ، هموگلوبینوپاتی ، چاقی و غیره) ؛ 2) واکنش های پارانئوپلاستیک (تومورهای نوچک ، تومورهای قشر و مدولای غدد فوق کلیوی ، غده هیپوفیز ، تخمدان ها ، تومورهای عروقی ، تومورهای اندام های دیگر) ؛ 3) ایسکمی کلیه
(تنگی شریان کلیوی ، هیدرونفروز ، پلی کیستیک و سایر ناهنجاری های کلیه). 4) دلایل ناشناخته (بیماری سیستم عصبی مرکزی ، فشار خون بالا پورتال).
اریتروسیتوز نسبی با اگزوزوز (کم آبی بدن به دلیل اسهال ، استفراغ ، تعریق زیاد و غیره) مشاهده می شود. تشخیص افتراقی بر اساس در نظر گرفتن کل تصویر بالینی است. در موارد دشوار ، لازم است محتوای اریتروپویتین در خون بررسی شود. با اریترمی افزایش نمی یابد.
فرمولاسیون یک تشخیص بالینی دقیق شامل اطلاعات مربوط به 1) مرحله بیماری است. 2) وجود عوارض ؛ 3) مرحله روند (تشدید یا بهبودی) ؛ 4) وجود سندرم های برجسته (فشار خون بالا پورتال ، فشار خون بالا و غیره).
رفتار. کل مجموعه اقدامات درمانی برای ER به شرح زیر است.
در مرحله پیشرفته بیماری ، در حضور سندرم پلیتریک ، اما بدون لکو- و ترومبوسیتوز ، از خونگیری به عنوان یک روش درمانی مستقل استفاده می شود ، در حالی که دستیابی به کاهش سطح هماتوکریت به مقادیر طبیعی (کمتر از 45 45) ضروری است. 400-500 میلی لیتر خون را یک روز در میان (در بیمارستان) یا 2 روز بعد (در یک کلینیک پلی کلینیک) خارج کنید. برای پیشگیری از ترومبوز (ایجاد در نتیجه خونریزی و همچنین عارضه اریترمی) ، استیل سالیسیلیک اسید با دوز 0.5-1 گرم در روز در آستانه و در روز تزریق خون و سپس طی 1-2 هفته پس از پایان خون ریزی تجویز می شود. علاوه بر اسید استیل سالیسیلیک ، سایر مواد ضدعفونی کننده نیز تجویز می شوند - تیکلید ، پلاویک ، پنتوکسی فیلین. قبل از عمل جراحی فلبوتومی ، برای پیشگیری از آمبولی ریوی ، توصیه می شود 5000 IU هپارین به صورت وریدی (از طریق سوزن Dufo) و همچنین 5000 IU هپارین زیر پوست شکم ، 2 بار در روز و به مدت چند روز پس از عمل فلبوتومی تزریق شود. با تحمل ضعیف خونریزی ، در افراد با آترواسکلروز شدید عروق مغزی مشاهده می شود ، خروج به 350 میلی لیتر (2 بار در هفته) محدود می شود. با خونریزی ، کاهش هموگلوبین به 150 گرم در لیتر ضروری است.
اگر خون ریزی به اندازه کافی م ،ثر نباشد و همچنین در اشکال بیماری که با پانسیوتوز و اسپلنومگالی اتفاق می افتد ، درمان سیتوستاتیک تجویز می شود. سن بیماران بالای 55 سال موارد استفاده از سیتواستاتیک را گسترش می دهد. علائم غیرمستقیم برای سیتوستاتیک درمانی از دیگر علائم سندرم مایلوپرولیفراتیو (خارش) و همچنین شدت بیماری ، عوارض عروقی احشایی (سکته مغزی ، انفارکتوس میوکارد) ، خستگی است.
موارد منع مصرف سیتوستاتیک درمانی: سن کم بیماران ، مقاومت در برابر درمان در مراحل قبلی و همچنین سیتوستاتیک درمانی بیش از حد فعال در گذشته به دلیل ترس از انتقال بیماری به مرحله کم خونی. اثر سیتوستاتیک درمانی باید 3 ماه پس از پایان درمان ارزیابی شود. این به این دلیل است که گلبول های قرمز تولید شده قبل از درمان به طور متوسط \u200b\u200bحدود 2-3 ماه زندگی می کنند. کاهش تعداد لکوسیت ها و پلاکت ها مطابق با شرایط زندگی آنها خیلی زودتر اتفاق می افتد. ملاک اثربخشی درمان سیتواستاتیک دستیابی به بهبودی خون (کامل است ، وقتی همه پارامترهای خون نرمال می شوند ، یا جزئی ، که در آن تعداد گلبول های قرمز ، لکوسیت ها و / یا پلاکت ها تا حدی افزایش می یابد).
از داروهای سیتوستاتیک در مرحله اول ، هیدروکسی اوره (هیدره) معمولاً با دوز 30-50 میلی گرم در هر کیلوگرم در روز تجویز می شود (2-3 کپسول در هر
روز) در طول درمان ، لازم است تعداد لکوسیت ها کنترل شود. Hydrea با یک اینترفرون با دوز 3-5 میلیون واحد بین المللی زیر جلدی 3-7 بار در هفته برای مدت طولانی (حداقل یک سال) ترکیب می شود ، که این امر باعث می شود تا ترومبوسیتوز ، پلوتورا و خارش متوقف شود.
برای هیپرترومبوسیتوز ، از آناگرلید استفاده می شود.
نتایج اریترامی (میلوفیبروز ، لوسمی حاد ، لوسمی میلوئیدی مزمن) بر اساس اصول درمان این بیماری ها تحت تأثیر قرار می گیرد: برای میلوفیبروز ، استروئیدهای آنابولیک ، نیتواستاتیک و انتقال جرم گلبول قرمز استفاده می شود. در سرطان خون حاد ، پلی شیمی درمانی در سرطان خون میلوئیدی مزمن - داروهای سیتوستاتیک نشان داده شده است.
درمان علامتی برای حملات اریترومالالژی با عوامل ضد پلاکتی ، داروهای ضد التهاب غیر استروئیدی (استیل سالیسیلیک اسید ، ایندومتاسین) انجام می شود. فشار خون شریانی ، حملات آنژین مطابق با قوانین درمان این شرایط از بین می رود.
در صورت بروز عوارض گلبول قرمز توسط ترومبوز عروقی ، از درمان ضد انعقاد و ضد پلاکت استفاده می شود.
بیماران مبتلا به اریترامی با تکرار مراجعه به پزشک و تعیین آزمایش خون محیطی 1 بار در 3 ماه در پرونده های دارویی قرار می گیرند.
پیش بینی. با یک دوره بدون عارضه اریترمی ، امید به زندگی می تواند به 15-20 سال برسد (عوارض بعدی ایجاد می شود). اگر عوارض ناشی از سیستم قلبی عروقی به اندازه کافی زود باشد یا بیماری پیشرفت کند ، امید به زندگی کاهش می یابد. درمان به موقع آغاز شده امید به زندگی را افزایش می دهد ، اگرچه این مورد در همه موارد مشاهده نمی شود.
جلوگیری. اقدامات اساسی برای جلوگیری از بیماری وجود ندارد و بنابراین ما فقط می توانیم در مورد پیشگیری ثانویه صحبت کنیم ، که شامل مشاهده پویا بیماران و انجام درمان ضد عود است.
سرطان خون میلوئیدی مزمن یک فرآیند انکولوژیکی است که در سلولهای نابالغ بافت خون ساز واقع در پارانشیم طحال و مغز استخوان ایجاد می شود. این بیماری برای زندگی انسان خطرناک است ، زیرا توسعه آن با یک تغییر پاتولوژیک در خون همراه است و منجر به مرگ زودرس می شود. اگر یک بیمار مبتلا به سرطان خون مزمن میلوئیدی باشد ، نیاز به مراقبت های پزشکی فوری است.
آسیب انکولوژیکی سلولهای خونساز میلوئیدی ، پیش سازهای لکوسیتهای دانه ای ، که مزمن است ، در بیشتر موارد (95 از 100 مورد) با ظهور کروموزوم غیرطبیعی در آنها همراه است ، که به گفته محل کشف ، فیلادلفیا نام داشت.
وقوع این نوع جهش به شرح زیر اتفاق می افتد:
- به دلیل تأثیر برخی عوامل منفی بر روی بدن انسان ، ژنهای abl از کروموزوم 9 و bcr از کروموزوم 22 ادغام می شوند.
- ترکیب پاتولوژیک تشکیل یک پروتئین غیر طبیعی ABL-BCR را تحریک می کند ، که روند بدخیمی سلول خون را فعال می کند.
- سلول انفجاری که به دلیل اختلال کروموزومی ، لکوسیت دانه ای میلوئیدی آینده جهش یافته است ، در رشد خود متوقف شده و شروع به تقسیم فعال می کند ، و یک ساختار تومور در مغز استخوان تشکیل می دهد.
- کلون های سلول های غیر طبیعی خون وارد جریان خون می شوند ، در آنجا نیز به طور فعال رشد می کنند ، پلاکت های سالم ، لکوسیت ها و گلبول های قرمز را آواره می کنند ، در نتیجه عملکرد سیستم گردش خون کاملاً مختل می شود.
وقوع چنین نقض در DNA لکوسیت ها و افزایش کنترل نشده خون سلول های غیر طبیعی منجر به ایجاد سرطان در سیستم گردش خون می شود. اما تشخیص لوسمی میلوئیدی مزمن در مرحله شروع تقریباً هرگز امکان پذیر نیست ، زیرا این وضعیت پاتولوژیک برای مدت طولانی با علائم خاصی همراه نیست که می تواند باعث اضطراب در فرد شود.
سرطان خون میلوئیدی مزمن در کودکان
بیماری انکولوژیکی از این نوع برای بیماران کوچک معمول نیست ؛ فراوانی تشخیص فقط 5-5٪ موارد بالینی کلیه لوسمی های دوران کودکی است.
این وضعیت پاتولوژیک می تواند در یک کودک کوچک در یکی از دو نوع رخ دهد:
- لوسمی میلوئید مزمن نوجوان (نوجوان). این نوع بیماری "بزرگسال" محسوب می شود و پس از 5 سالگی در کودکان شیوع دارد. از ویژگی های مشخص این نوع بیماری وجود کروموزوم فیلادلفیا در ساختار لکوسیت ها است.
- لوسمی میلوئیدی نوزاد (بچه های کم رشد ، کودکان). این نوع بیماری عمدتا نوزادان زیر دو سال را درگیر می کند و در صورت عدم وجود کروموزوم غیرطبیعی در سلولهای بلاست ، از فرم جوانی متفاوت است. یکی دیگر از ویژگی های مشخصه این نوع بیماری ، کاهش قابل توجه تعداد لکوسیت ها در خون در کودکان بیمار است که در مرحله اولیه رشد بیماری آسیب دیده است ، که منجر به خونریزی مکرر می شود ، که متوقف کردن آن بسیار دشوار است.
ارزش دانستن دارد! هرچه کودک کوچکتر باشد ، بیماری حادتر پیشرفت می کند. غالباً ، نوع لوسمی میلوئیدی در دوران کودکی غیرقابل درمان است - مرگ کودک به دلیل رشد زودرس ترومبوسیتوپنی خیلی سریع اتفاق می افتد و منجر به خونریزی داخلی گسترده می شود ، که متوقف کردن آن اغلب غیرممکن است.
طبقه بندی سرطان خون میلوئیدی مزمن
در عمل بالینی ، سرطان خون میلوئیدی مزمن معمولاً به مراحل مختلفی تقسیم می شود که سلولهای خونی ساختارهای تومور را تشکیل می دهند.
توسعه لوسمی میلوئیدی مزمن از 3 مرحله عبور می کند ، که هر مرحله با علائم بالینی خاص و تغییرات مورفولوژیکی در خون مشخص می شود:
- مرحله مزمن یا شروع یک روند آسیب شناختی. سرطان خون میلوئیدی مزمن به تدریج شروع به توسعه می کند. اول از همه ، تکثیر میلوئید (رشد بافتهای مغز استخوان به دلیل فعال شدن تقسیم سلول بلاست) رخ می دهد ، که منجر به ظهور تغییرات خاص در خون می شود. در این مرحله علائم بالینی عمومی وجود ندارد ، بنابراین ، سرطان خون میلوئیدی مزمن در ابتدای رشد معمولاً یک یافته تصادفی است.
- مرحله شتاب یا انتقالی. در این مرحله ، علائم بالینی ضعیف است و می توان وضعیت بیماران را پایدار دانست. فقط علائم بافت شناسی تغییر می کنند - افزایش ترکیب کمی لکوسیت ها و میلوسیت ها آغاز می شود.
- ترمینال ، فاز نهایی مرحله نهایی بیماری با ظهور علائم بالینی مشخصی قابل تحمل است که برای بیماران دشوار است. شکل ظاهری آنها نشان دهنده آغاز بحران انفجار است. یکی از ویژگی های این بیماری که همیشه با فاز نهایی همراه است ، انفارکتوس طحال و افزایش آشکار آن به دلیل تجمع تعداد زیادی سلول بلاست در اندام خونساز است. در بیش از نیمی از بیماران در این مرحله از بیماری ، فیبروز (بزرگ شدن بافت) مغز استخوان مشخص می شود.
ارزش دانستن دارد! معمولاً می توان در آخرین مرحله بیماری ، لوسمی میلوئیدی مزمن مغز استخوان ، طحال و خون را تشخیص داد ، که با عدم وجود علائم خاص در مرحله 1 و 2 همراه است. چنین موذیانه ای از بیماری منجر به مرگ مکرر می شود ، اما رشد آهسته آن ، که می تواند برای سالها ادامه داشته باشد ، این تصویر را روشن می کند ، زیرا در بسیاری از بیماران هنگام تشخیص بیماری دیگر ، ممکن است یک بیماری پاتولوژیک را در مرحله اولیه شناسایی کنید.
علل تحریک پاتولوژی خون
لوسمی میلوئیدی مزمن اولین و تنها بیماری انکولوژیک است که علت آن به طور قابل اعتماد مشخص شده است. پیش شرط اصلی تحریک شروع بیماری ، ظهور کروموزوم غیرطبیعی در سلولهای بلاست اندامهای خونساز است. بیماری ناشی از چنین جهش ژنتیکی بسیار کند رشد می کند و فرد می تواند تا سنین پیری زندگی کند بدون اینکه از وجود سرطان در خون خود آگاهی داشته باشد. اما ایجاد لوسمی میلوئیدی مزمن نیز سریع است.
اگر عوامل خطر خاصی در زندگی فرد وجود داشته باشد ، بیماری می تواند به سرعت و در چند ماه به مرحله نهایی برسد ، که اصلی ترین آنها عبارتند از:
- زندگی در مناطقی با تابش زمینه بالا یا مناطقی در مجاورت نیروگاه های هسته ای.
- درمان طولانی مدت با سیتواستاتیک یا مصرف کنترل نشده داروهای ضد باکتری با افزایش سمیت ؛
- قرار گرفتن منظم ، طولانی مدت ، در معرض مواد سمی و شیمیایی در بدن انسان ؛
- سابقه یک فرد در مورد سندرم های کلاینفلتر یا داون.
اگر حداقل یکی از این عوامل خطر در زندگی فرد وجود داشته باشد ، باید توجه بیشتری به وضعیت سلامتی خود داشته باشد و در صورت بروز حداقل اختلالات سلامتی ، برای مشاوره با یک متخصص مشورت کنید. همچنین ، به افرادی که در معرض خطر هستند ، توصیه می شود سالانه از روش های پیشگیری استفاده کنند. تشخیص به موقع تغییرات پاتولوژیک در ترکیب خون به شما امکان می دهد شکل مزمن سرطان خون میلوئیدی را به طور کامل بهبود دهید.
علائم پاتولوژی اندام های خونساز
علائم بیماری برای مدت طولانی وجود ندارد ، اولین علائم اختصاصی سرطان خون میلوئیدی مزمن ، که فرد را مضطرب می کند و به پزشک مراجعه می کند ، معمولاً در مرحله نهایی بیماری ، زمانی که درمان آن غیرممکن است ، ظاهر می شود. مرحله اولیه بیماری با علائم تاری و خفیف مشخص می شود. اما با دانستن آنها ، می توان به ایجاد یک بیماری آسیب شناختی مشکوک شد و با تماس به موقع با یک متخصص هماتو-انکولوژیک ، لوسمی میلوئید مزمن را در مرحله اولیه تشخیص داد که کاملاً قابل درمان است.
علائم اصلی که باید نگران کننده باشند عبارتند از:
- تورم غدد لنفاوی؛
- کم خونی ، مشخصه رنگ پریدگی پوست ؛
- احساس مداوم بیماری و خستگی ؛
- کاهش بی دلیل اشتها و کاهش وزن ؛
- ظاهر کبودی و کبودی روی پوست ؛
- خونریزی مکرر و طولانی مدت خارجی یا داخلی ؛
- احساس پری در سمت چپ حفره شکم به دلیل افزایش اندازه طحال.
این علائم برای بسیاری از بیماری ها معمولی است ، اما نمی توان ظاهر آنها را نادیده گرفت ، زیرا ممکن است به طور غیر مستقیم نشان دهنده آنکولوژی خون باشد. اغلب ، به لطف شکایت بیمار از وجود این علائم است که می توان به موقع بیماری خطرناکی را تشخیص داد.
تشخیص شامل روش های آزمایشگاهی و ابزاری برای تأیید یا رد پیشرفت بیماری است
در صورت مشکوک بودن به سرطان خون مزمن میلوئید ، پزشک قبل از هر چیز یک آنامز را جمع آوری کرده و معاینه فیزیکی را انجام می دهد ، که به شما امکان می دهد تغییرات در پوست ، افزایش غدد لنفاوی ، طحال و کبد را تشخیص دهید ، به طور غیر مستقیم نشان دهنده وجود یک روند آسیب شناختی از بدخیمی در سیستم خونساز انسانی است. در صورت وجود این علائم ، بیماران مشکوک به سرطان خون میلوئیدی مزمن برای آزمایش های تشخیصی ویژه فرستاده می شوند که اصلی ترین آنها تشخیص آزمایشگاهی است ، از جمله:
- عمومی و بیوشیمیایی ، که با کمک آن ترکیب کمی و کیفی مایع بیولوژیکی ثبت می شود ؛
- بررسی بافت شناسی مواد بیوپسی گرفته شده توسط سوراخکاری با سوزن ریز از مغز استخوان.
برای روشن شدن ماهیت سرطان خون مزمن میلوئیدی ، برای همه بیماران یک مورد دیگر تجویز می شود. بیشترین اطلاعات در این بیماری اشعه ایکس ، معاینه سونوگرافی حفره شکم ، CT و MRI است. با استفاده از این تکنیک ها ، متخصصان نه تنها ماهیت فرآیند سرطان شناسی را روشن می کنند ، بلکه وجود کانون های بدخیم ثانویه را نیز شناسایی می کنند.
فیلم آموزنده
انواع درمان سرطان خون میلوئیدی مزمن: دارو ، جراحی ، پرتودرمانی
تمام اقدامات درمانی مورد استفاده برای متوقف کردن فرآیند انکولوژیکی که به اندام های خونساز ضربه وارد کرده است ، توسط متخصص خون ، آناتولوژیست بر اساس مرحله رشد بیماری ، علائم عمومی مشخص کننده سیر آن و شدت تصویر بالینی لوسمی میلوئید مزمن همراه تجویز می شود.
اقدامات درمانی بسته به مرحله بیماری به طور جداگانه به هر بیمار اختصاص می یابد:
- در مرحله اولیه و مزمن ، هیچ درمان خاصی لازم نیست. برای حفظ حالت پایدار در بیماران ، درمان ترمیمی برای آنها تجویز می شود که شامل اصلاح تغذیه ، کاهش فعالیت بدنی و مشاهده رژیم کار و استراحت است.
- مرحله فعال شدن لوسمی میلوئیدی مزمن نیاز به گسترش اقدامات درمانی دارد. بیماران باید دوره های بیولوژیکی درمانی با اینترفرون و شیمی با کلرتیل آمینوراسیل ، هگزافوسفامید یا میتوبرونیتول را طی کنند. با توجه به نشانه ها می توان آن را تعیین کرد.
- با شروع بحران انفجار ، درمان بی فایده می شود. در این مرحله آخر بیماری ، بیماران به طور انحصاری علائم درمانی دریافت می کنند ، که به آنها امکان می دهد علائم دردناک بیماری را کاهش دهند و کیفیت زندگی را تا روزهای آخر حفظ کنند.
پیش بینی های بازیابی
متوقف کردن سرطان خون مزمن میلوئیدی فقط در مرحله اولیه روند آسیب شناسی امکان پذیر است ، به شرطی که درمان به درستی انجام شود. اما این بسیار نادر اتفاق می افتد ، زیرا تشخیص به موقع بیماری مشکلات جدی را ایجاد می کند. بیشتر بیماران در مرحله انتقالی یا انتهایی لوسمی میلوئیدی مزمن می میرند. از تشخیص بیماری تا شروع مرگ در این مراحل بیماری ، حدود دو سال طول می کشد. یک خطر خاص شروع بحران انفجار است - در این مرحله ، بیماران سرطانی بیش از شش ماه زندگی نمی کنند. نامطلوب ترین آن وجود کروموزوم غیرطبیعی فیلادلفیا در ژن های خون است.
پیشگیری از سرطان خون میلوئید
امروزه اقدامات پیشگیرانه خاصی برای پیشگیری از سرطان خون مزمن میلوئیدی وجود ندارد. تنها موردی که متخصصان خون و هماتولوژی به افرادی که در معرض خطر ایجاد فرآیند سرطان در اندام های خونساز هستند ، توصیه می کنند انجام مطالعات غربالگری منظم است.
- با قرار دادن در فهرست روزانه غذاهای غنی شده با مجتمع های ویتامین و مواد معدنی.
- رد کامل اعتیاد (سیگار کشیدن ، سو abuse مصرف الکل ، پرخوری در شب) ، یا به حداقل رساندن آنها ؛
- حفظ یک سبک زندگی فعال و سالم با ورزش منظم در ورزشهای عملی.
- کاهش قرار گرفتن در معرض اشعه ماورا بنفش: اجتناب از قرار گرفتن در معرض نور مستقیم خورشید.
فیلم آموزنده