ترکیبات اکسیژن نیتروژنبا اکسیژن، نیتروژن مجموعه ای از اکسیدها را تشکیل می دهد: N 2 O و NO گازهای بی رنگ هستند، N 2 O 3 آبی است. جامد(زیر 100- درجه سانتیگراد)، NO 2 - گاز قهوه ای، N 2 O 4 - گاز بی رنگ، N 2 O 5 - کریستال های بی رنگ. اکسید N 2 O (اکسید نیتروژن، "گاز خنده"، زیرا دارای اثر مخدر است) با تجزیه حرارتی نیترات آمونیوم یا هیدروکسی آمونیوم به دست می آید: [НN 3 OH]NO 2 \u003d N 2 O + 2H 2 O (نسبت درون مولکولی ) اکسید نیتریک (+ 1) - ترکیب گرماگیر. با این حال، در دمای اتاق از نظر شیمیایی کمی فعال است. هنگامی که گرم می شود، واکنش پذیری آن به شدت افزایش می یابد. هیدروژن، فلزات، فسفر، گوگرد، زغال سنگ، آلی و مواد دیگر را اکسید می کند، به عنوان مثال: Cu + N 2 O \u003d N 2 + CuO هنگامی که N 2 O بالای 700 درجه سانتیگراد گرم می شود، عدم تناسب آن به طور همزمان با واکنش تجزیه انجام می شود. : \u003d 2N 2 + O 2; 2N 2 O \u003d 2NO + N 2 اکسید نیتریک (+1) با آب تعامل ندارد ، اگرچه اسید H 2 N 2 O 2 شناخته شده است که در آن نیتروژن نیز حالت اکسیداسیون +1 دارد. این اسید را اسید نیتریک می نامند و ساختاری با دو اتم نیتروژن معادل به آن نسبت می دهند: اسید نیتروژن آزاد را می توان به صورت زیر بدست آورد: NH 2 OH + HNO 2 \u003d H 2 N 2 O 2 + H 2 O به خوبی حل می شود. در آب، اما اسید ضعیف است. اسید نیتروژن بسیار ناپایدار است، با حرارت کمی منفجر می شود: H 2 N 2 O 2 \u003d N 2 O + H 2 O نمک های H 2 N 2 O 2 - هیپونیتریت ها و هیدروهیپونیتریت ها - بسیار مستعد هیدرولیز در آب هستند. اکثر هیپونیتریت ها کمی در آب محلول هستند، هیدروهیپونیتیت ها خیلی بهتر حل می شوند. حتی حالت های اکسیداسیون برای نیتروژن نسبتاً نامشخص است. از جمله این ترکیبات اکسید نیتریک (+2) است. مولکول NO شامل عدد فردالکترون ها و در اصل یک رادیکال با فعالیت کم است. مولکول دارای یک کووالانس بر اساس مکانیسم دهنده-گیرنده و دو پیوند P است. با وجود گرما بودن و ارزش مثبت انرژی گیبس از تشکیل NO از مواد ساده، اکسید نیتریک (2+) به عناصر تجزیه نمی شود. واقعیت این است که طبق MMO، ترتیب اوراق بهادار در NO بسیار بالا و برابر با 2.5 است. مولکول NO از مولکول O 2 قوی تر است، زیرا اولی فقط یک الکترون روی MO P 2p * شل دارد و دومی دو الکترون دارد. در آزمایشگاه، اکسید نیتریک (+2) اغلب با اثر اسید رقیق روی براده های مس به دست می آید: 3Cu + 8HNO 3 \u003d 3Cu (NO 3) 2 + 2NO + 4H 2 O در هوا، اکسید نیتریک (+2) ) فوراً اکسید می شود: 2NO + O 2 \u003d 2NO 2 توسط NO و هالوژن اکسید می شود و نیتروزیل هالیدها را تشکیل می دهد: 2NO + Г 2 \u003d 2NOG هنگام تعامل با عوامل کاهنده، NO به N 2 O، N 2 OH کاهش می یابد. ، NH 3، بسته به توانایی کاهشی شریک و شرایط برای ارائه فرآیندها محلول اکسید آبی نیتروژن (+2) خنثی است. هیچ ترکیبی با آب ایجاد نمی کند، اگرچه نمک ها (هیپونیترات) اسید نیتریک H 2 N 2 O 3 در حالت آزاد جدا نشده اند، که در آن نیتروژن نیز حالت اکسیداسیون 2+ دارد، شناخته شده است. اکسید نیتریک N 2 O 3 در حالت جامد (زیر 100- درجه سانتیگراد) وجود دارد. در حالت مایع و بخار، اکسید نیتریک (+3) به دلیل عدم تناسب تا حد زیادی تفکیک می شود: N 2 O 3 NO + NO 2 N 2 O 3 با سرد کردن مقادیر هم مولی NO و NO 2 به دست می آید. و یک جریان یکنواخت از مخلوطی از ترکیب مورد نظر با برهمکنش با 50٪ HNO 3 با اکسید آرسنیک (+3): 2HNO 3 + As 2 O 3 \u003d 2HAsO 3 + NO + NO 2 اسید نیتروژن HNO 2 به دست می آید. می توان آن را با حل کردن حجم های مساوی NO و NO 2 در آب در آب به دست آورد: NO + NO 2 + H 2 O \u003d 2HNO 2 در طول ذخیره سازی و گرم کردن، HNO 2 نامتناسب: 3HNO 2 \u003d HNO 3 + 2NO + H 2 خواص O: HNO 2 + 2HI \u003d I 2 + 2NO + 2H 2 O با این حال، عوامل اکسید کننده قوی اسید نیتروژن را به اسید نیتریک تبدیل می کنند: 5HNO 2 + 2KmnO 4 + 3H 2 SO 4 \u003d K 2 SO 4 + 2MnHNO4 + 3 + 3H 2 O اکسید نیتروژن (+4) با حل کردن مس در اسید نیتریک غلیظ به دست می آید: Cu + 4HNO 3 = Cu (NO 3) 2 + 2NO 2 + 2H 2 O یک اکسید کننده خوب، فسفر، گوگرد است. زغال سنگ و مقداری مواد آلی. در دمای بالای 150 درجه سانتیگراد، دی اکسید نیتروژن شروع به تجزیه می کند: 2NO 2 \u003d 2NO + O 2 از آنجایی که مولکول دی اکسید نیتروژن با یک الکترون جفت نشده اساسا یک رادیکال است، به راحتی دیمر می شود: 2NO 2 N 2 O 4 - رنگ قهوه ای و پارامگنتیک. هنگام تعامل با آب، دی اکسید نیتروژن نامتناسب است: 2NO 2 + H 2 O \u003d HNO 2 + HNO 3 هنگامی که NO 2 در آب داغ حل می شود، اسید نیتریک به دست می آید، زیرا اسید نیتروژن اولیه با آزاد شدن اکسید نیتریک نامتناسب است ( +2) و تشکیل اسید نیتریک. اکسید نیتریک (+5) فقط در فاز گاز ساختار مولکولی دارد. در حالت جامد، N 2 O 5 دارای ساختاری است که توسط یون های NO 2 + و NO 3 - تشکیل شده است. N 2 O 5 - کریستال ها به راحتی تصعید می شوند و مولکول ها تبخیر می شوند. بنابراین، در طول تصعید اکسید نیتریک (+5)، یون های NO 2 + و NO 3 - به مولکول های N 2 O 5 ترکیب می شوند. اکسید نیتریک (+5) با کم آبی اسید نیتریک با P 2 O 5 یا با اکسیداسیون NO 2 با ازن به دست می آید: 2HNO 3 + P 2 O 5 \u003d 2HPO 3 + N 2 O 5. 6NO 2 + O 3 \u003d 3N 2 O 5 اکسید نیتریک (+5) یک عامل اکسید کننده پر انرژی است ، بسیاری از واکنش ها با مشارکت آن بسیار سریع انجام می شود. وقتی در آب حل شود می دهد اسید نیتریک : N 2 O 5 + H 2 O \u003d 2HNO 3 اسید نیتریک یکی از اسیدهای قوی است. مولکول HNO 3 و یون نیترات دارای ساختاری هستند که در نمودارها نشان داده شده است اسید نیتریک بی آب یک مایع فرار بی رنگ است. در طول ذخیره سازی (مخصوصاً در نور) و هنگام گرم شدن، تا حدی تجزیه می شود: 4HNO 3 \u003d 4NO 2 + 2H 2 O + O 2 اسید نیتریک به اصطلاح "فور" (قرمز) محلولی از دی اکسید نیتروژن آزاد شده در غلیظ است. HNO 3. در آزمایشگاه، HNO 3 با حرارت دادن نیترات سدیم با اسید سولفوریک به دست می آید: NaNO 3 + H 2 SO 4 = HNO 3 + NaHSO 4 در صنعت، اسید نیتریک از آمونیاک به دست می آید. ابتدا آمونیاک به صورت کاتالیزوری به اکسید نیتریک (+2) اکسید می شود که بیشتر به NO 2 اکسید می شود. سپس اکسید نیتریک (4+) را در آب داغ حل کرده و اسید نیتریک به دست می آید. اسید نیتریک یک عامل اکسید کننده قوی است و تقریباً تمام فلزات و غیر فلزات را اکسید می کند. دومی، به عنوان یک قاعده، توسط آن به مشتقاتی با بالاترین حالت اکسیداسیون تبدیل می شود، به عنوان مثال: S + 6HNO 3 \u003d H 2 SO 4 + 6NO 2 + 2H 2 O از فلزات، فقط طلا، پلاتین، اسمیم، ایریدیوم، نیوبیم، تانتالم و تنگستن در برابر عمل اسید نیتریک مقاوم هستند. برخی از فلزات (به عنوان مثال، آهن، آلومینیوم، کروم) با اسید نیتریک غلیظ غیرفعال می شوند. محلول های آبی اسید نیتریک نیز خاصیت اکسید کنندگی دارند. به طور معمول، فرآیند کاهش HNO 3 در چندین جهت موازی پیش می رود و نتیجه مخلوطی از محصولات احیای مختلف است. ماهیت این محصولات، محتوای نسبی آنها در مخلوط به قدرت عامل کاهنده، غلظت اسید نیتریک و دما بستگی دارد. یک عامل اکسید کننده قوی تر مخلوطی از اسیدهای نیتریک و هیدروکلریک غلیظ - "آکوا رژیا" است. حتی طلا و پلاتین را که در نیتریک حل نمی شوند و حتی بیشتر در اسید هیدروکلریک حل می کند. فعالیت اکسیداتیو آن به دلیل کاهش پتانسیل اکسیداسیون و کاهش فلزات در محلول است، به عنوان مثال، افزایش خواص کاهشی آنها به دلیل تشکیل کمپلکس های کلرید قوی: Au + HNO 3 + 4HCl = H [AuCl 4] + NO + 2H 2 O نمک های اسید نیتریک - نیترات ها - تقریباً برای تمام فلزات شناخته شده اند. بیشتر آنها بی رنگ هستند و به راحتی در آب حل می شوند. در محلول های آبی اسیدی، نیترات ها عامل اکسید کننده ضعیف تری نسبت به اسید نیتریک هستند و در محیط خنثی به هیچ وجه خاصیت اکسید کنندگی ندارند. هنگامی که تجزیه با آزاد شدن اکسیژن اتفاق می افتد، آنها عوامل اکسید کننده قوی در مذاب ها هستند. اکسید نیتریک (+5)، هنگام تعامل با 100٪ پراکسید هیدروژن، اسید پراکسونیتریک (نازوت) را تشکیل می دهد: N 2 O 5 + 2H 2 O 2 \u003d 2HNO 4 + H 2 O اسید پراکسونیتریک ناپایدار است، به راحتی منفجر می شود، کاملاً هیدرولیز می شود. آب: O H-O-O-N + H 2 O \u003d H 2 O 2 + HNO 3 O ترکیبات با غیر فلزاتهمه هالیدهای نیتروژن NG 3 شناخته شده هستند. تری فلوراید NF 3 از برهمکنش فلوئور با آمونیاک به دست می آید: 3F 2 + 4NH 3 = 3 NH 4 F + NF 3 نیتروژن تری فلوراید یک گاز سمی بی رنگ است که مولکول های آن ساختار هرمی دارند. اتم های فلوئور در قاعده هرم قرار دارند و قسمت بالای آن توسط یک اتم نیتروژن با یک جفت الکترون مشترک اشغال شده است. برای معرف های شیمیایی مختلف و گرمایش، NF 3 بسیار پایدار است. تری هالیدهای نیتروژن باقیمانده گرماگیر هستند و بنابراین ناپایدار و واکنش پذیر هستند. NCl 3 با عبور کلر گازی به محلول قوی کلرید آمونیوم تشکیل می شود: 3Cl 2 + NH 4 Cl \u003d 4HCl + NCl 3 تری کلرید نیتروژن یک مایع بسیار فرار (t kip \u003d 71 درجه سانتیگراد) با بوی تند است. حرارت یا ضربه خفیف با انفجار همراه با انتشار مقدار زیادی گرما همراه است. در این حالت NCl 3 به عناصر تجزیه می شود. تری هالیدهای NBr 3 و NI 3 حتی کمتر پایدار هستند. مشتقات نیتروژن با کالکوژن ها به دلیل گرما بودن قوی بسیار ناپایدار هستند. همه آنها ضعیف مطالعه شده اند، هنگام گرم شدن منفجر می شوند و ضربه می زنند. اتصالات با فلزاتنیتریدهای نمک مانند از سنتز مستقیم از فلزات و نیتروژن به دست می آیند. نیتریدهای نمک مانند با آب و اسیدهای رقیق تجزیه می شوند: Mg 3 N 2 + 6N 2 \u003d 3Mg (OH) 2 + 2NH 3 Ca 3 N 2 + 8HCl \u003d 3CaCl 2 + 2NH 4 Cl هر دو واکنش ماهیت اولیه فعال را ثابت می کند. نیتریدهای فلزی نیتریدهای فلز مانند از حرارت دادن فلزات در اتمسفر نیتروژن یا آمونیاک به دست می آیند. به عنوان مواد اولیه می توان از اکسیدها، هالیدها و هیدریدهای فلزات واسطه استفاده کرد: 2Та + N 2 = 2ТаN. Mn 2 O 3 + 2NH 3 \u003d 2MnN + 3H 2 O CrCl 3 + NH 3 \u003d CrN + 3HCl. 2TiH 2 + 2NH 3 \u003d 2TiN + 5H 2 استفاده از نیتروژن و ترکیبات حاوی نیتروژندامنه نیتروژن بسیار بزرگ است - تولید کود، مواد منفجره، آمونیاک، که در پزشکی استفاده می شود. کودهای حاوی نیتروژن با ارزش ترین هستند. چنین کودهایی عبارتند از نیترات آمونیوم، اوره، آمونیاک، نیترات سدیم. نیتروژن بخشی جدایی ناپذیر از مولکول های پروتئین است، به همین دلیل است که گیاهان برای رشد و نمو طبیعی به آن نیاز دارند. چنین ترکیب مهمی از نیتروژن و هیدروژن مانند آمونیاک در کارخانه های تبرید استفاده می شود، آمونیاک که از طریق یک سیستم بسته لوله ها در گردش است، مقدار زیادی گرما را در طول تبخیر خود می گیرد. نیترات پتاسیم در تولید پودر سیاه و باروت در تفنگ های شکاری برای اکتشاف کانی های معدنی که در زیر زمین وجود دارند استفاده می شود. باروت بدون دود از پیروکسیلین، یک استر سلولز و اسید نیتریک به دست می آید. مواد منفجره آلی مبتنی بر نیتروژن برای تونل زنی در کوه ها استفاده می شود (TNT، نیتروگلیسیرین). فسفر تاریخچه کشف فسفرفسفر در سال 1669 توسط کیمیاگر برانت کشف شد، زمانی که او در جستجوی "سنگ فیلسوف"، بقایای خشک ادرار را با زغال سنگ بدون دسترسی به هوا به شدت گرم کرد. ماده جدا شده در هوا می درخشد و سپس مشتعل می شود. برای این خاصیت، برانت نام "فسفر" را به او داد، یعنی. حامل نور ("نور حامل"). پس از کشف برای صد سال دیگر، فسفر یک ماده کمیاب و گران قیمت بود، زیرا. محتوای آن در ادرار ناچیز است و دریافت آن دشوار است. و تنها پس از سال 1771، زمانی که شیمیدان سوئدی Scheele روشی را برای به دست آوردن فسفر از استخوان ها ایجاد کرد، امکان بدست آوردن آن در مقادیر قابل توجهی فراهم شد. ویژگی های فسفردومین عنصر معمولی، عنصر معمولی در گروه پنجم، غیرفلزی است. بالاترین حالت اکسیداسیونی که فسفر می تواند نشان دهد 5+ است. ترکیبات حاوی فسفر در حالت اکسیداسیون کمتر از 5+ به عنوان عوامل کاهنده عمل می کنند. در عین حال، ترکیبات فسفر + 5 در محلول ها عامل اکسید کننده نیستند. ترکیبات اکسیژن فسفر پایدارتر از ترکیبات نیتروژن هستند. ترکیبات هیدروژنی پایداری کمتری دارند. ترکیبات طبیعی و بدست آوردن فسفراز نظر شیوع در پوسته زمین، فسفر از نیتروژن، گوگرد و کلر جلوتر است. برخلاف نیتروژن، فسفر در طبیعت فقط به صورت ترکیبات وجود دارد. مهم ترین کانی های فسفر آپاتیت Ca 5 X (PO 4) 3 (X فلوئور است و کمتر کلر و گروه هیدروکسید است) و فسفریت که اساس آن Ca 3 (PO 4) 2 است. علاوه بر این، فسفر بخشی از برخی از مواد پروتئینی است و در گیاهان و موجودات حیوانات و انسان یافت می شود. از مواد خام طبیعی حاوی فسفر، فسفر آزاد با کاهش دمای بالا (1500 درجه سانتیگراد) با کک در حضور ماسه به دست می آید. دومی اکسید کلسیم را به سرباره - سیلیکات کلسیم متصل می کند. در مورد کاهش فسفریت، واکنش کلی را می توان با این معادله نشان داد: Ca 3 (PO 4) 2 + 5C + 3SiO 2 \u003d CaSiO 3 + 5CO + P 2 مونوکسید کربن و فسفر بخار حاصل وارد یخچال می شود. با آب، که در آن تراکم با تشکیل فسفر سفید جامد رخ می دهد. خواص فیزیکی و شیمیاییدر دمای زیر 1000 درجه سانتیگراد، بخار فسفر حاوی مولکولهای P4 چهار اتمی است که به شکل چهار وجهی است. در دماهای بالاتر، تفکیک حرارتی رخ می دهد و محتوای مولکول های P2 دو اتمی در مخلوط افزایش می یابد. فروپاشی دومی به اتم های فسفر در بالای 2500 درجه سانتیگراد رخ می دهد. اصلاح سفید فسفر که از تراکم بخارات حاصل می شود، دارای یک مولکولی است. شبکه کریستالی، که در گره های آن مولکول های P 4 قرار دارند. به دلیل ضعف نیروهای بین مولکولی، فسفر سفید فرار، قابل ذوب، با چاقو بریده شده و در حلال های غیر قطبی مانند دی سولفید کربن حل می شود. فسفر سفیدماده بسیار واکنش پذیر به شدت با اکسیژن، هالوژن ها، گوگرد و فلزات واکنش نشان می دهد. اکسیداسیون فسفر در هوا با گرم شدن و درخشش همراه است. بنابراین، فسفر سفید در زیر آب ذخیره می شود که با آن واکنش نشان نمی دهد. فسفر سفید بسیار سمی است. در طول نگهداری طولانی مدت، و همچنین هنگام گرم شدن، فسفر سفید به یک تغییر قرمز تبدیل می شود. فسفر قرمز یک ماده پلیمری است که در دی سولفید کربن نامحلول است و سمیت کمتری نسبت به فسفر سفید دارد. فسفر قرمز سخت تر از سفید اکسید می شود، در تاریکی نمی درخشد و فقط در دمای 250 درجه سانتیگراد مشتعل می شود. پایدارترین اصلاح فسفر، فسفر سیاه است. با تبدیل آلوتروپیک فسفر سفید در دمای 220 درجه سانتیگراد و فشار 1200 مگاپاسکال به دست می آید. توسط ظاهرشبیه گرافیت است ساختار کریستالی فسفر سیاه به صورت لایه ای است که از لایه های موجدار تشکیل شده است. همانطور که در فسفر قرمز، در اینجا هر اتم فسفر با پیوندهای کووالانسی با سه همسایه متصل است. فاصله بین اتم های فسفر 0.387 نانومتر است. فسفر سفید و قرمز دی الکتریک هستند، در حالی که فسفر سیاه یک نیمه هادی با فاصله نواری 0.33 eV است. از نظر شیمیایی، فسفر سیاه کمترین واکنش را دارد؛ فقط زمانی که در دمای بالای 400 درجه سانتیگراد گرم شود مشتعل می شود. فسفر در تعامل با فلزات یک عملکرد اکسید کننده از خود نشان می دهد: 3Ca + 2P = Ca 3 P 2 به عنوان یک عامل کاهنده، فسفر در واکنش با غیر فلزات فعال - هالوژن ها، اکسیژن، گوگرد و همچنین با عوامل اکسید کننده قوی: 2P + 3S عمل می کند. = P 2 S 3 2P + 5S \u003d P 2 S 5 به روشی مشابه با اکسیژن و کلر در تعامل است. P + 5HNO 3 \u003d H 3 RO 4 + 5NO 2 + H 2 O در محلول های قلیایی ، هنگام گرم شدن ، فسفر سفید نامتناسب است: 8P + 3Ba (OH) 2 + 6H 2 O \u003d 2РН 3 + 3Ва (H 2 ) ) 2 اسیدهای حاوی فسفر و نمکهای آنهااکسید فسفر شیمیایی (+3) ماهیت اسیدی دارد: P 2 O 3 + 3H 2 O \u003d 2H 3 RO 3 اسید فسفر بلورهای بی رنگ، قابل ذوب و محلول در آب است. با توجه به ساختار شیمیایی آن یک چهار وجهی تحریف شده است که در مرکز آن یک اتم فسفر با اوربیتال های هیبریدی sp 3 قرار دارد و رئوس آن توسط دو گروه هیدروکسو و اتم های هیدروژن و اکسیژن اشغال شده است. یک اتم هیدروژن که مستقیماً به فسفر متصل است قادر به جایگزینی نیست و بنابراین اسید فسفر حداکثر دو باز است و اغلب با فرمول H 2 [HPO 3] نشان داده می شود. اسید فسفر یک اسید با قدرت متوسط است. نمک های آن - فسفیت ها از برهم کنش P 2 O 3 با مواد قلیایی به دست می آیند: P 2 O 3 + 4NaOH \u003d 2Na 2 HPO 3 + H 2 O فسفیت های فلزات قلیایی و کلسیم به راحتی در آب حل می شوند. هنگام گرم شدن، اسید فسفر نامتناسب می شود: 4H 3 RO 3 \u003d PH 3 + 3H 3 RO 4 اسید فسفر توسط بسیاری از عوامل اکسید کننده از جمله هالوژن ها اکسید می شود، به عنوان مثال: H 3 RO 3 + Cl 2 + H 2 O \u003d H 3 RO 4 + 2HCl معمولاً اسید فسفر را با هیدرولیز تری هالیدهای فسفر بدست می آورید: RG 3 + 3H 2 O \u003d H 3 RO 3 + 3NG هنگامی که فسفیت های تک جایگزین گرم می شوند، نمک های اسید پیروفسفری (دی فسفره) (دی فسفر) PO2Pyrophaites به دست می آیند: u003d Na 2 H 2 P 2 O 5 + H 2 O پیروفسفیت ها هنگام جوشاندن با آب هیدرولیز می شوند: Na 2 H 2 P 2 O 5 + 3H 2 O \u003d 2NaOH + 2H 3 PO 3 خود اسید پیروفسفر H 4 P 2 O 5 (pentaoxodiphosphoric)، مانند فسفر، فقط دو پایه و نسبتاً ناپایدار است. یکی دیگر از اسیدهای فسفر (+3) شناخته شده است - اسید متافسفر پلیمری (HPO 2) n. مهمترین مشخصه فسفر اکسید P 2 O 5 - پنتوکسید دی فسفر است. این ماده جامد سفید رنگی است که به راحتی در حالت شیشه ای به دست می آید. در حالت بخار، مولکول های اکسید فسفر (5+) دارای ترکیب P 4 O 10 هستند. جامد R 2 O 5 تغییرات متعددی دارد. یکی از اشکال اکسید فسفر (+5) دارای ساختار مولکولی با مولکول های P 4 O 10 در محل های شبکه است. از نظر ظاهری، این اصلاح شبیه یخ است. چگالی کمی دارد، به راحتی به بخار تبدیل می شود، در آب بسیار محلول است و واکنش پذیر است. P 2 O 5 قوی ترین عامل آب زدایی است. از نظر شدت اثر خشک کردن، بسیار بیشتر از جاذبهای رطوبت مانند CaCl 2، NaOH، H2SO4 و غیره است. وقتی P2O5 هیدراته میشود، متا اسید فسفریک: P 2 O 5 + H 2 O \u003d 2HPO 3، هیدراتاسیون بیشتر آن به طور متوالی منجر به اسید پیروفسفریک و اورتوفسفریک می شود: 2HPO 3 + H 2 O \u003d H 4 P 2 O 7 و H 4 P 2 O 7 + H 2 O \u003d 2H 3 PO 4 اسید اورتوفسفریک یکی از مهم ترین مشتقات فسفر است (+5). اینها بلورهای بی رنگ، کم ذوب، رقیق شده در هوا، قابل اختلاط با آب به هر نسبت هستند. در اسیدهای جامد و محلول های غلیظ، پیوندهای هیدروژنی بین مولکولی عمل می کنند. بنابراین، محلول های قوی H 3 PO 4 بسیار ویسکوز هستند. در محیط آبی، اسید فسفریک اسیدی با قدرت متوسط است. در یک محلول آبی، ارتوفسفات ها - نمک های اسید فسفریک - تحت هیدرولیز قرار می گیرند و pH محیط به طور طبیعی هنگام انتقال از نمک متوسط به اسیدی کاهش می یابد. Na 3 RO 4 + H 2 O \u003d NaOH + Na 2 HPO 4 ، pH \u003d 12.1 Na 2 HPO 4 + H 2 O \u003d NaOH + NaH 2 PO 4 ، pH \u003d 8.9 وقتی فسفر مرطوب همراه با P اکسید می شود 2 O 5 و P 2 O 3 اسید فسفریک (هگزااکسودی فسفریک) اسید H 4 P 2 O 6 را تشکیل می دهند که در آن حالت اکسیداسیون فسفر +4 است. در ساختار آن، اتم های فسفر به طور مستقیم به یکدیگر متصل هستند، برخلاف اسیدهای پلی فسفریک: H 4 P 2 O 6 اسیدی با قدرت متوسط است، هر چهار اتم هیدروژن آن را می توان با یک فلز جایگزین کرد. وقتی آن را گرم کرد محلول آبیاسید، با اضافه کردن آب، تجزیه می شود: H 4 P 2 O 6 + H 2 O \u003d H 3 RO 3 + H 3 RO 4 محلول های نمک های آن - هیپوفسفات ها - در آب کاملاً پایدار هستند. از میان هیپوفسفات ها، تنها نمک های فلزات قلیایی بسیار محلول در آب هستند. کوچکترین حالت اکسیداسیون مثبت فسفر در اسید هیپوفسفر (دیوکسوفسفریک) H 3 PO 2. می توان آن را در حالت آزاد با جابجایی از نمک ها - هیپوفسفیت ها به دست آورد، به عنوان مثال: Ba (H 2 PO 2) 2 + H 2 SO 4 \u003d BaSO 4 + 2H 3 PO 2 اسید فسفر - کریستال های بی رنگ، به راحتی در آب محلول . بنابراین، در اسید هیپوفسفر، حالت اکسیداسیون فسفر 1+ و کووالانسی آن 5 است. H 3 PO 2 یک اسید قوی است. این اسید و نمک های هیپوفسفیت آن قوی ترین عوامل کاهنده هستند. اسیدهای دیگری حاوی فسفر هستند - مونوپر فسفریک H 3 PO 5، دیناد فسفریک H 4 P 2 O 8، تترا متافسفریک (HPO 3) 4، پیروفسفریک H 4 P 2 O 7. ترکیبات فسفر با غیر فلزاتفسفر و هیدروژن به شکل مواد ساده عملا برهم کنش ندارند. مشتقات هیدروژن فسفر به طور غیر مستقیم به دست می آیند، به عنوان مثال: Ca 3 P 2 + 6HCl \u003d 3CaCl 2 + 2PH 3 فسفین PH 3 یک گاز بی رنگ و بسیار سمی با بوی ماهی فاسد است. مولکول فسفین را می توان به عنوان یک مولکول آمونیاک در نظر گرفت. با این حال، زاویه بین پیوندهای H-R-Hبسیار کمتر از آمونیاک این به معنای کاهش سهم s-cloudها در تشکیل پیوندهای هیبریدی در مورد فسفین است. پیوندهای فسفر با هیدروژن از پیوندهای نیتروژن با هیدروژن استحکام کمتری دارند. خواص اهداکننده فسفین کمتر از آمونیاک است. قطبیت کم مولکول فسفین و فعالیت ضعیف پذیرش پروتون منجر به عدم وجود پیوند هیدروژنی نه تنها در حالت مایع و جامد، بلکه همچنین با مولکول های آب در محلول ها و همچنین به پایداری کم یون فسفونیوم می شود. РН 4 + . پایدارترین نمک فسفونیوم در حالت جامد یدید آن PH 4 I است. آب و به خصوص محلول های قلیایی نمک های فسفونیوم به شدت تجزیه می شوند: PH 4 I + KOH = PH 3 + KI + H 2 O نمک های فسفین و فسفونیوم مواد احیا کننده قوی هستند. در هوا، فسفین به اسید فسفریک می سوزد: PH 3 + 2O 2 \u003d H 3 PO 4 هنگامی که فسفیدهای فلزی فعال توسط اسیدها تجزیه می شوند، دی فسفین P 2 H 4 به عنوان ناخالصی همزمان با فسفین تشکیل می شود. دی فسفین یک مایع فرار بی رنگ است که از نظر ساختار مولکولی شبیه هیدرازین است، اما فسفین خواص اولیه را نشان نمی دهد. به طور خود به خود در هوا مشتعل می شود، وقتی در نور ذخیره می شود و وقتی گرم می شود تجزیه می شود. محصولات پوسیدگی آن حاوی فسفر، فسفین و ماده بی شکلرنگ زرد. این محصول هیدروژن فسفید جامد نامیده می شود و فرمول P 12 H 6 به آن نسبت داده می شود. با هالوژن ها، فسفر سه و پنتا هالیدها را تشکیل می دهد. این مشتقات فسفر برای همه آنالوگ ها شناخته شده اند، اما ترکیبات کلر عملا مهم هستند. WG 3 و WG 5 سمی هستند، آنها به طور مستقیم از مواد ساده به دست می آیند. WG 3 - ترکیبات گرمازا پایدار؛ PF 3 گازی بی رنگ، PCl 3 و PBr 3 مایعات بی رنگ و PI 3 کریستال های قرمز هستند. در حالت جامد، تمام تری هالیدها بلورهایی با ساختار مولکولی تشکیل می دهند. RG 3 و RG 5 ترکیبات تشکیل دهنده اسید هستند: PI 3 + 3H 2 O \u003d 3NI + H 3 PO 3 هر دو نیترید فسفر شناخته شده اند که مربوط به حالت های سه و پنج کووالانسی است: PN و P 2 N 5. در هر دو ترکیب نیتروژن سه ظرفیتی است. هر دو نیترید از نظر شیمیایی بی اثر هستند، در برابر آب، اسیدها و قلیاها مقاوم هستند. فسفر مذاب گوگرد را به خوبی حل می کند، اما برهمکنش شیمیایی زمانی اتفاق می افتد درجه حرارت بالا. از سولفیدهای فسفر، Р 4 S 3 , Р 4 S 7 , Р 4 S 10 بهتر مورد مطالعه قرار می گیرند. این سولفیدها را می توان در مذاب نفتالین تبلور مجدد کرد و به صورت کریستال های زرد جدا کرد. هنگامی که گرم می شود، سولفیدها مشتعل می شوند و می سوزند و P 2 O 5 و SO 2 تشکیل می دهند. آب همه آنها به آرامی با آزاد شدن سولفید هیدروژن و تشکیل اسیدهای اکسیژن فسفر تجزیه می شوند. ترکیبات فسفر با فلزاتبا فلزات فعال، فسفر فسفیدهای نمک مانند را تشکیل می دهد که از قوانین ظرفیت کلاسیک پیروی می کنند. p-فلزات، و همچنین فلزات زیر گروه روی، فسفیدهای نرمال و غنی از آنیون می دهند. بیشتر این ترکیبات دارای خواص نیمه هادی هستند، به عنوان مثال. پیوند غالب در آنها کووالانسی است. تفاوت بین نیتروژن و فسفر، به دلیل اندازه و عوامل انرژی، بیشتر در برهمکنش این عناصر با فلزات واسطه آشکار می شود. برای نیتروژن، هنگام تعامل با دومی، نکته اصلی تشکیل نیتریدهای فلز مانند است. فسفر همچنین فسفیدهای فلز مانند را تشکیل می دهد. بسیاری از فسفیدها، به ویژه آنهایی که پیوند عمدتاً کووالانسی دارند، نسوز هستند. بنابراین، AlP در دمای 2197 درجه سانتیگراد ذوب می شود و فسفید گالیم دارای نقطه ذوب 1577 درجه سانتیگراد است. فسفیدهای فلزات قلیایی و قلیایی خاکی با آزاد شدن فسفین به راحتی توسط آب تجزیه می شوند. بسیاری از فسفیدها نه تنها نیمه هادی هستند (AlP، GaP، InP)، بلکه فرومغناطیس مانند CoP و Fe 3P نیز هستند. استفاده از فسفر و مواد حاوی فسفرفسفر قرمز به صورت خالص در تولید کبریت استفاده می شود. در مخلوطی با شیشه خرد شده و چسب، روی سطوح کناری قوطی کبریت اعمال می شود. از فسفر قرمز و سفید در تولید اسیدهای هیدرویدیک و هیدروبرومیک استفاده می شود. روی فسفید Zn 3 P 2 برای کنترل جوندگان استفاده می شود. فسفر سفید در امور نظامی برای بمب های آتش زا و همچنین برای گلوله های دودزا، چکرز و نارنجک هایی که پرده های دود می دهد استفاده می شود. استفاده از ایزوتوپ رادیواکتیو P 32 فسفر باعث شد تا رفتار فسفر در گیاهان، خاک و کودها به روشی جدید مشخص شود. حساسیت استثنایی تعیین فسفر رادیواکتیو این امکان را فراهم می کند که سیر دریافت فسفات در گیاهان، توزیع و تبدیل آنها در گیاهان را دنبال کنیم. اسید فسفریک خالص در صنایع غذایی و دارویی استفاده می شود. اسید فسفریک فنی برای رنگرزی پارچه، تولید لعاب، پرکردن دندان و همچنین برای تولید کودهای فسفاته استفاده می شود. ادبیات: 1. Ugay Ya. A. شیمی عمومی و معدنی: Proc. برای دانشجویان دانشگاهی که در جهت و ویژه تحصیل می کنند. "علم شیمی". - م.: بالاتر. مدرسه.، 1997. 2. Khodakov Yu. V. شیمی معدنی. اد. چهارم، بازنگری شده م.، "روشنگری"، 1972. 3. شیمی معدنی، ویرایش شده توسط I. N. Zaozersky. م.: بالاتر. مدرسه 1963
این کشور آبی دارای نیتروژن و فسفر بود. یک بار آزوت تصمیم گرفت برای قدم زدن در پارک برود. در آنجا فسفر را دید
سندفسفر در کت و شلوار سفید با پیراهن زرد و کراوات زرد بود. وقتی همدیگر را دیدند با هم آشنا شدند. فسفر بلافاصله متوجه شد که آزوت دائماً رنگ پریده است، کت و شلوار سفید مایل به شفافی پوشیده و هرگز ادکلن نپوشیده است.
Elena Aleksandrovna Solovieva بهبود فناوری حذف نیتروژن و فسفر در مجتمع تصفیه فاضلاب و تصفیه لجن (1)
سنددفاع در تاریخ 16 مارس 2010 ساعت 14:00 در جلسه شورای دفاع از پایان نامه های دکترا و کارشناسی ارشد D.212.223.06 در دانشگاه دولتی معماری و عمران سنت پترزبورگ به آدرس:
Elena Aleksandrovna Solovieva بهبود فناوری حذف نیتروژن و فسفر در مجتمع تصفیه فاضلاب و تصفیه لجن (2)
سنددفاع در تاریخ 16 مارس 2010 ساعت 14:00 در جلسه شورای دفاع از پایان نامه های دکتری و کارشناسی ارشد D 212.223.06 در دانشگاه دولتی معماری و عمران سنت پترزبورگ به آدرس:
تصفیه فاضلاب شهری از نیتروژن و فسفر با استفاده از دوزهای بالای لجن فعال
چکیدهاین کار در موسسه آموزشی دولتی عالی انجام شد آموزش حرفه ایدانشگاه ایالتی معماری و مهندسی عمران سنت پترزبورگ و شرکت واحد دولتی مسکو "Mosvodokanal".
توسعه درس شیمی "نیتروژن و فسفر عناصر زندگی هستند."
توسعه درسآماده سازی اولیه. دانش آموزان به صورت گروهی گزارش های خلاقانه ای در مورد یکی از مواد (نیتروژن، آمونیاک، اسید نیتریک، نیترات، فسفر) تهیه می کنند. اگر امکان اجرای بازی در کلاس کامپیوتر وجود دارد، توصیه می کنم یک پروژه را سازماندهی کنید
در ترکیبات اکسیژننیتروژن حالت اکسیداسیون 1+ تا 5+ را نشان می دهد.
N2O; نه N 2 O 3 ; NO2; N 2 O 4 ; N 2 O 5
اکسیدهای N 2 O و NO غیر نمک ساز هستند، بقیه نمک ساز هستند.
اکسید نیتریک (I) و اکسید نیتریک (II) گازهای بی رنگ، اکسید نیتریک (III) یک مایع آبی، (IV) یک گاز قهوه ای، (V) بلورهای بی رنگ شفاف است.
به جز N 2 O، همه آنها بسیار سمی هستند. اکسید نیتروژن N 2 O اثر فیزیولوژیکی بسیار عجیبی دارد که اغلب به آن گاز خنده می گویند. در اینجا شیمیدان انگلیسی هامفری دیوی، که از این گاز برای ترتیب جلسات ویژه استفاده میکرد، عملکرد اکسید نیتروژن را شرح میدهد: «برخی از آقایان روی میز و صندلی میپریدند، برخی دیگر زبانشان باز میشد، برخی دیگر تمایل شدیدی به نزاع نشان میدادند». استنشاق N 2 O باعث از بین رفتن درد می شود و بنابراین در پزشکی به عنوان بی حس کننده استفاده می شود.
MVS در یک مولکول فرض می کند N2Oحضور یون های N + و N-
هیبریداسیون sp
| ↓ | ↓ | ↓ | ↓ |
| ↓ | ↓ | ↓ | ↓ |
به دلیل هیبریداسیون sp، یون N + پیوند 2σ می دهد: یکی با N - و دیگری با یک اتم اکسیژن. این پیوندها با زاویه 180 درجه نسبت به یکدیگر جهت دارند و مولکول N 2 O خطی است. ساختار یک مولکول با جهت پیوند σ تعیین می شود. دو الکترون p باقیمانده در N + یک پیوند π دیگر تشکیل می دهند: یکی با یون N و دیگری با اتم اکسیژن. از این رو N 2 O دارای ساختار است
: N - = N + = O :
تمایل NO 2 به دیمر شدن نتیجه تعداد فرد الکترون در مولکول (پارامغناطیس) است.
مشکلات جدی با اکسیدهای نیتروژن همراه است. مشکلات زیست محیطی. افزایش غلظت آنها در جو منجر به تشکیل اسید نیتریک و بر این اساس، باران اسیدی می شود.
N 2 O 3 با آب تعامل می کند، اسید نیتروژن ناپایدار HNO 2 را تشکیل می دهد که فقط در محلول های رقیق وجود دارد، زیرا به راحتی تجزیه می شود.
2HNO 2 \u003d N 2 O 3 + H 2 O.
همانطور که توسط مقادیر پتانسیل های استاندارد الکترود مشهود است، HNO 2 می تواند یک عامل کاهنده قوی تر از HNO 3 باشد.
HNO 3 + 2 H + + 2e \u003d HNO 2 + H 2 O E 0 \u003d + 0.93 ولت
HNO 2 + H + + 1e = NO + H 2 O E 0 = + 1.10 ولت
HNO 2 + 1e \u003d NO + H + E 0 \u003d + 1.085 ولت
نمک های نیتریت آن پایدار هستند. HNO 2 یک اسید با قدرت متوسط (K ≈ 5 10-4) است. همراه با تفکیک اسید، تفکیک به میزان کمی با تشکیل NO + و OH - رخ می دهد.
درجه اکسیداسیون نیتروژن در نیتریت ها متوسط است (3+) بنابراین در واکنش ها می تواند هم به عنوان یک عامل اکسید کننده و هم به عنوان یک عامل احیا کننده رفتار کند. دارای دوگانگی ردوکس است.
عوامل اکسید کننده قوی NO 2 - را به NO 3 - تبدیل می کنند.
5NaNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5 NaNO 3 + 2MnSO 4 + K 2 SO 4 + 3H 2 O
عوامل کاهنده قوی معمولا HNO 2 را به NO کاهش می دهند.
2NaNO 2 + 2KI + 2H 2 SO 4 = Na 2 SO 4 + 2NO + I 2 + K 2 SO 4 + 2H 2 O
همچنین ممکن است فرآیند عدم تناسب، افزایش و کاهش همزمان درجه اکسیداسیون اتم های همان عنصر وجود داشته باشد.
3HNO 2 \u003d HNO 3 + 2NO + H 2 O
نیتریت ها سمی هستند: هموگلوبین را به متهموگلوبین تبدیل می کنند که قادر به حمل اکسیژن نیست و باعث تشکیل نیتروزامین R 2 N-NO، مواد سرطان زا، در غذا می شود.
مهمترین ترکیب نیتروژن HNO 3 است
اسید نیتریک - محصول ضروریصنایع شیمیایی اصلی این به تهیه مواد منفجره، داروها، رنگ ها، پلاستیک ها، الیاف مصنوعی و سایر مواد می رود.
HNO 3 یک مایع بی رنگ با بوی خفه کننده تند است که در هوا دود می کند. در مقادیر کم، در جریان تخلیه رعد و برق تشکیل می شود و در آب باران وجود دارد.
N 2 + O 2 → 2NO
2NO + O 2 → 2NO 2
4NO 2 + O 2 + 2H 2 O → 4HNO 3
HNO 3 بسیار غلیظ معمولاً به دلیل فرآیند تجزیه در نور یا هنگام گرم شدن، رنگ قهوه ای دارد.
4HNO 3 \u003d 4NO 2 + 2H 2 O + O 2
HNO 3 یک ماده بسیار خطرناک است.
مهمترین خاصیت شیمیایی HNO 3 این است که یک عامل اکسید کننده قوی است و بنابراین تقریباً با تمام فلزات به جز طلا، پلاتین، Rh، آهن، تیتانیم، تا، فلزات Al، Fe، Co، Ni و Cr برهم کنش دارد و «غیرفعال» می شود. . اسید، بسته به غلظت و فعالیت فلز، می تواند به ترکیبات کاهش یابد:
+4 +3 +2 +1 0 -3 -3
NO 2 → HNO 2 → NO → N 2 O → N 2 → NH 3 (NH 4 NO 3)
و نمک اسید نیتریک نیز تشکیل می شود.
به عنوان یک قاعده، برهمکنش اسید نیتریک با فلزات، هیدروژن تولید نمی کند. تحت تأثیر HNO 3 بر روی فلزات فعال، هیدروژن به دست می آید. با این حال، هیدروژن اتمی در زمان آزاد شدن دارای خواص احیایی قوی است و اسید نیتریک یک عامل اکسید کننده قوی است. بنابراین هیدروژن به آب اکسید می شود.
خواص HNO 3 غلیظ و رقیق شده
1) اثر HNO 3 غلیظ بر فلزات کم فعال (مس، جیوه، نقره)
Cu + 4 HNO 3 \u003d Cu (NO 3) 2 + 2NO 2 + 2H 2 O
2) اثر HNO 3 رقیق بر فلزات کم فعال
3Cu + 8 HNO 3 \u003d 3Cu (NO 3) 2 + 2NO + 4H 2 O
3) اثر اسید غلیظ بر روی فلزات فعال
4Ca + 10HNO 3 \u003d 4Ca (NO 3) 2 + N 2 O + 5H 2 O
4) اثر HNO 3 رقیق بر فلزات فعال
4Ca + 10 HNO 3 \u003d 4Ca (NO 3) 2 + NH 4 NO 3 + 3H 2 O
یکی از قوی ترین اسیدها، همه واکنش های اسیدی مشخصه است: با اکسیدهای بازی، بازها، اکسیدهای آمفوتریک، هیدروکسیدهای آمفوتریک واکنش می دهد. یک ویژگی خاص یک اکسیداتیو برجسته است. بسته به شرایط (غلظت، ماهیت عامل کاهنده، دما)، HNO 3 می تواند از 1 تا 8 الکترون بپذیرد.
تعدادی از ترکیبات N با حالت های اکسیداسیون مختلف:
NH3; N 2 H 4 ; NH2OH؛ N2O; نه N 2 O 3 ; NO2; N 2 O 5
NO 3 - + 2H + + 1e \u003d NO 2 + H 2 O
NO 3 - + 4H + + 3e \u003d NO + 2H 2 O
2NO 3 - + 10H + + 8e \u003d N 2 O + 5H 2 O
2NO 3 - + 12H + + 10e \u003d N 2 + 6H 2 O
NO 3 - + 10H + + 8e \u003d NH 4 - + 3H 2 O
تشکیل محصولات به غلظت بستگی دارد، هر چه غلظت بالاتر باشد، عمق کمتری بازسازی می شود. با تمام فلزات به جز طلا، پلاتین، W واکنش می دهد. HNO 3 غلیظ در شرایط عادی با آهن، کروم، آلومینوم که با آن غیرفعال می شود، برهمکنش نمی دهد، اما زمانی که به شدت گرم شود با این فلزات واکنش می دهد.
اکثر غیر فلزات و مواد پیچیده توسط HNO 3 به NO (کمتر NO 2) کاهش می یابد.
3P + 5HNO 3 + 2H 2 O = 3H 3 PO 4 + 5NO
S + HNO 3 \u003d H 2 SO 4 + 2NO
3C + 4HNO 3 \u003d 3CO 2 + 4NO + 2H 2 O
ZnS + 8HNO 3 k \u003d ZnSO 4 + 8NO 2 + 4H 2 O
6HCl + 2HNO 3 k \u003d 3Cl 2 + 2NO + 4H 2 O
ثبت یک واکنش ردوکس شامل HNO 3 معمولاً مشروط است، زیرا مخلوطی از ترکیبات حاوی نیتروژن تشکیل می شود و نشان دهنده محصول کاهشی است که در مقدار بیشتری تشکیل شده است.
طلا و فلزات پلاتین در "آکوا رژیا" حل می شوند - مخلوطی از 3 حجم اسید هیدروکلریک غلیظ و 1 حجم اسید نیتریک غلیظ که دارای قوی ترین خاصیت اکسید کننده است، "سلطان فلزات" - طلا را حل می کند.
Au + HNO 3 + 4HCl \u003d H + NO + 2H 2 O
HNO 3 - یک اسید مونوبازیک قوی، تنها نمک های متوسط - نیترات ها را تشکیل می دهد که از اثر آن بر روی فلزات، اکسیدها، هیدروکسیدها یا کربنات ها به دست می آیند. تمام نیترات ها در آب بسیار محلول هستند. محلول های آنها دارای خواص اکسید کننده ناچیزی است.
هنگامی که گرم می شود، نیترات ها تجزیه می شوند. نیترات های فلزات قلیایی به نیتریت تبدیل شده و اکسیژن آزاد می شود.
2KNO 3 \u003d 2KNO 2 + O 2
ترکیب سایر محصولات به موقعیت فلز در ECEP بستگی دارد.
در سمت چپ Mg \u003d MeNO 2 + O 2به منیزیم
MeNO 3 \u003d Mg - Cu \u003d MeO + NO 2 + O 2سمت راست منیزیم
در سمت راست Cu = Me + NO 2 + O 2فلزات کمتر فعال
ترکیبات نیتروژن با اکسیژن
در بین عناصر دوره دوم، نیتروژن بیشترین تعداد اکسیدهای مختلف را تشکیل می دهد. همه آنها از نظر ترمودینامیکی مواد ناپایدار هستند که می توانند به نیتروژن و اکسیژن تجزیه شوند یا به مواد دیگر اکسیژن اهدا کنند و خاصیت اکسید کنندگی از خود نشان می دهند. مشخصات فیزیکیاکسیدهای نیتروژن در جدول ارائه شده است. 20.2.
جدول 20.2
ویژگی های اکسیدهای نیتروژن
واکنش گرماگیر بین اکسیژن و نیتروژن در دمای حدود 2000 درجه سانتیگراد انجام می شود (به بالا مراجعه کنید). خروجی نیتریک اکسید (II) NO حاصل تنها 2-3٪ است. هنگامی که مخلوط سرد می شود، تعادل به سمت تشکیل مواد ساده تغییر می کند، یعنی. اکسید تجزیه می شود اگر خنکسازی سریع انجام شود، تعادل زمانی برای جابجایی ندارد و NO حاصل در مخلوط باقی میماند، زیرا سرعت تجزیه و همچنین سرعت تشکیل تقریباً به صفر میرسد. واکنش بین اکسیژن و نیتروژن در اتمسفر فقط در هنگام تخلیه رعد و برق رخ می دهد که منجر به آلودگی محسوس جو با اکسیدها نمی شود.
نیتروژن. AT کلان شهرهاافزایش قابل توجهی در غلظت NO و W) 2 در هوا ناشی از عملکرد موتورهای اتومبیل است. تحت شرایط خاص هواشناسی، غلظت آنها می تواند به حداکثر مقدار مجاز 1 میلی گرم بر متر مکعب برسد. اکسید نیتریک (II) سمی است، اما در غلظت حدود 10-8 مول در لیتر، لازم است لحن طبیعی عروق خونی حفظ شود. داروهامانند نیتروگلیسیرین اکسید نیتریک را تشکیل می دهند و به انبساط عروق قلب کمک می کنند.
اکسید نیتریک (N) نیز در طی واکنش برخی از فلزات با اسید نیتریک با غلظت معین تشکیل می شود. به عنوان مثال، در واکنش 10٪ NH0 3 با براده های مس، محصول گازی اصلی NO است:
مهمترین واکنش تولید NO صنعتی، اکسیداسیون کاتالیزوری آمونیاک است (به زیر مراجعه کنید).
در مولکول N0، شش الکترون در پیوند و یک الکترون در اوربیتال آنتی پیوند قرار دارند:
تعدد پیوند در این مولکول 2.5 است. با توجه به این واقعیت که الکترون جفت نشده در یک اوربیتال ضد پیوند قرار دارد، مولکول NO فعالیت شیمیایی بالایی رادیکال های آزاد معمولی را نشان نمی دهد.
اکسید نیتریک (N) که اکسیژن تولید می کند، می تواند از احتراق برخی از عوامل کاهنده قوی، به عنوان مثال، منیزیم پشتیبانی کند:
NO به آسانی با اکسیژن واکنش نشان می دهد. هنگامی که با هوا مخلوط می شود، NO بی رنگ بلافاصله پفک های قهوه ای اکسید نیتریک (TN) را تشکیل می دهد:
![]()
در مولکول G) 2، اتم نیتروژن دارای یک الکترون جفت نشده در یک مدار غیر پیوندی (به جای شل شدن) است. بنابراین، این ماده در واکنش های ترکیبی فعال است. در حالت گازی، N0 2 زیر 140 درجه سانتیگراد، تعادل برقرار می شود
![]()
که با کاهش دما به سمت راست جابه جا می شود. با افزایش نسبت دایمر، رنگ ماده ضعیف می شود. در دمای 21.3 درجه سانتیگراد، گاز شروع به مایع شدن می کند و به مایع زرد رنگ تبدیل می شود که در 9.3- درجه سانتیگراد بلورهای بی رنگ را تشکیل می دهد. ناپدید شدن رنگ به این معنی است که جامد فقط از مولکول های N 2 0 4 تشکیل شده است. ساختار مولکول های دایمر متقارن است، پیوندهای 71 موجود در آنها غیرمحلی هستند:
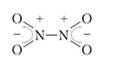
اتم نیتروژن با اهدای یک الکترون به اتم اکسیژن چهار پیوند کووالانسی قطبی را تشکیل می دهد. فاصله بین اتم های نیتروژن در این مولکول نسبتاً زیاد است - 164 نانومتر (در مولکول هیدرازین H 2 K-NH 2 تنها 146 نانومتر است) که دلیل بر سهولت شکستن این پیوند و فروپاشی دایمر است. به دو مولکول G) 2. مونومر و دایمر اکسید نیتریک (IV) را می توان یک ماده دانست که در حالت کریستالی و مایع از مولکول های N 2 0 4 تشکیل شده است و با تبخیر برخی از این مولکول ها به دو مولکول M0 2 تجزیه می شوند.
مولکولهای G) 2 نه تنها با یکدیگر ترکیب میشوند، بلکه وقتی سرد میشوند، با مولکولهای NO واکنش داده و اکسید نیتریک (N) N 2 0 3 را تشکیل میدهند. ایگو یک ماده ناپایدار است که به شکل مایع وجود دارد از رنگ آبیدر دمای کمتر از 3.5 درجه سانتیگراد مولکول N 2 0 3 متقارن نیست، با پیوند بین اتم های نیتروژن:
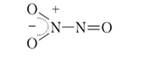
بدیهی است که اتم های نیتروژن حالت های اکسیداسیون متفاوتی دارند: +4 و +2، که مقدار متوسط 3+ را به دست می دهد. هر دو G^O^ و N 2 0 3 با آب واکنش داده و اسید تشکیل می دهند. اگر یک پروتون از مولکول H 2 0 به اتم اکسیژن در مولکول N 2 0 4 متصل شود، آنگاه تحت عمل یک بار مثبت، جفت الکترون اتصالات Y-Yدر جهت این بار حرکت می کند و پیوند شکسته می شود. در همان زمان، یک جفت الکترونی از اکسیژن از مولکول آب دیگر به مدار خالی اتم نیتروژن منتقل می شود. در نتیجه، اسیدهای نیتروژن و نیتریک تشکیل می شوند:
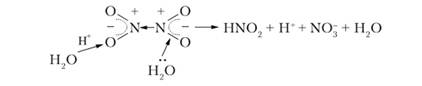
یون های آزاد OH و H + باقی مانده از مولکول های آب دوباره یک مولکول آب را تشکیل می دهند. معادله مولکولی واکنش به صورت زیر نوشته می شود:
واکنشی که طبق مکانیسم مشابهی بین اکسید نیتریک (N) و آب انجام می شود منجر به تشکیل تنها اسید نیتروژن می شود:
دو اکسید نیتروژن دیگر در اثر واکنش هایی تشکیل می شود که به برهمکنش مستقیم نیتروژن و اکسیژن مربوط نمی شود. اکسید نیتریک (1) N 2 0 همراه با بخار آب در طی تجزیه حرارتی نیترات آمونیوم آزاد می شود:
![]()
ترکیب گازی حاصل نام خاصی دارد - گاز خنده.با مخلوط کوچکی از N 2 0 در هوا، حالتی از برانگیختگی ایجاد می شود که در غلظت بالاتر N 2 0 به غش می رود. این ماده به عنوان بخشی از مخلوط ها برای بیهوشی استنشاقی استفاده می شود.
این مولکول به صورت نامتقارن ساخته شده است و در واقع اتم های نیتروژن دارند بنابراین 0 و +2:
![]()
حلالیت HO در آب تقریباً مشابه دی اکسید کربن است، اما اکسید نیتریک (1) با آب واکنش نمی دهد.
اکسید نیتریک بالاتر (U) N 2 0 5، یا انیدرید نیتریک، از آبگیری اسید نیتریک بخار با اکسید فسفر (U) به دست می آید. اسید به صورت قطره ای به پودر اضافه می شود P 2 0=;. گاز حاصل از N 2 0 5 با جریان اکسیژن به یک ظرف خنک شده منتقل می شود، جایی که بلورهای بی رنگ با نقطه ذوب 30 درجه سانتیگراد را تشکیل می دهد. راه دیگر برای به دست آوردن اکسید نیتریک (U) اکسید کردن NO 2 با ازن است.
مولکول N 2 0 5 شامل دو قطعه F) 2 است که از طریق یک اتم اکسیژن به هم متصل شده اند.
اکسید نیتریک (Y) ناپایدار است و به تدریج به اکسیژن و NO 2 تجزیه می شود. در دمای 0 درجه سانتیگراد نیمه عمر تقریباً 10 روز و در 20 درجه سانتیگراد - 10 ساعت است. اکسید نیتریک (U) رطوبت سنجی است - در هوای مرطوب پخش می شود و به سرعت با آب مایع واکنش می دهد و اسید نیتریک را تشکیل می دهد.