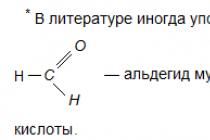
علم شیمی
شیمی معدنی عناصر و اتصالات آنها
7. کربن
خواص 6 S..
|
جرم اتمی |
کلارک، در٪ (عادی در طبیعت) |
||
|
پیکربندی الکترونیکی * |
وضع تجمع |
جامد |
|
|
almaz -Bestsv. گرافیت - خاکستری |
|||
|
انرژی یونیزاسیون
|
5000 (الماس) |
||
|
برق نسبی |
چگالی |
الماس - 3،51 گرافیت - 2,2 |
|
|
ممکن است درجه اکسیداسیون |
پتانسیل الکترود استاندارد |
* پیکربندی سطوح الکترونیکی خارجی اتم عنصر داده شده است. پیکربندی سطوح باقی مانده الکترونیکی همزمان با آن برای گاز نجیب است که دوره قبلی و موارد فوق ذکر شده در براکت ها است.
ایزوتوپ های کربن
کربن دارای دو ایزوتوپ پایدار است: 12 ثانیه (98.892٪) و 13 C (1.108٪). ایزوتوپ کربن رادیواکتیو بسیار مهم است 14 C، انتشار B-Rails با نیمه عمر 1/2 = 5570 سال ها. با استفاده از تجزیه و تحلیل رادیو کربن با تعیین غلظت ایزوتوپ 14 با دانشمندان توانستند به طور دقیق به طور دقیق سن سنگ های حاوی کربن، یافته های باستان شناسی، رویدادهای زمین شناسی را اهدا کنند.پیدا کردن در طبیعت در طبیعت، کربن در قالب کربن و الماس گرافیت، در ترکیبات - به شکل سنگ و ذغال سنگ قهوه ای و روغن یافت می شود. این بخشی از کربنات طبیعی است: سنگ آهک، سنگ مرمر، گچ
CACO 3، دولومیت CACO 3 H MGCO 3.. این بخش مهمی از مواد آلی است.مشخصات فیزیکی. اتم کربن دارای 6 الکترون است که 2 آن لایه داخلی را تشکیل می دهند
(1S 2)، 4 - خارجی (2s 2 2p 2 ) روابط کربن با عناصر دیگر عمدتا کووالانتی است. ارزش متعارف کربن - IV. یکی از ویژگی های فوق العاده اتمهای کربن، توانایی اتصال به یکدیگر با تشکیل زنجیرهای طولانی با دوام، از جمله بسته شده است. تعداد این ترکیبات بزرگ است، همه آنها موضوع را تشکیل می دهند شیمی ارگانیک .تفاوت در تغییرات Almostropic Carbon یک مثال واضح از اثر ساختار بلوری جامدات جامدات بر خواص فیزیکی آنها است. که در گرافیت اتم های کربن در یک دولت هستند
sP 2 - هیبریداسیون و تنظیم شده در لایه های موازی، تشکیل یک شبکه شش ضلعی. در داخل اتم های لایه بسیار قوی تر از بین لایه ها هستند، بنابراین خواص گرافیت در جهت های مختلف متفاوت است. بنابراین، توانایی گرافیت به حل و فصل با شکاف اوراق قرضه ضعیف تر در هواپیماهای کشویی همراه است.با فشار بسیار بالا و گرمایش بدون دسترسی به هوا از گرافیت، مصنوعی الماس در کریستال الماس، اتم های کربن در یک دولت هستند
SP 3. -HypeBridization، و بنابراین تمام اتصالات معادل و بسیار با دوام هستند. اتم ها یک قاب سه بعدی مداوم را تشکیل می دهند. الماس سخت ترین ماده موجود در طبیعت است.کمتر شناخته شده دو آلترپ کربن دیگر - کربین و فولرین
خواص شیمیایی. کربن در حالت آزاد معمولی است عامل کاهنده. هنگامی که اکسیداسیون اکسیژن در هوا اضافی، آن را به اکسید کربن تبدیل می شود (IV):
![]()
با کمبود اکسید کربن (II):
![]()
هر دو واکنش بسیار اکسترمی هستند.
هنگامی که کربن گرم در فضای اکسید کربن (IV) گرم می شود مونوکسید کربن:
![]()
کربن بسیاری از فلزات را از اکسید خود بازسازی می کند:
![]()
بنابراین واکنش ها با کادمیوم، مس، جریان اکسید سرب. هنگامی که کربن با اکسید فلزات قلیایی زمین، آلومینیوم ارتباط برقرار می کند و برخی از فلزات دیگر تشکیل می شود کاربید:

این به این واقعیت توضیح داده شده است که فلزات فعال عامل های کاهش دهنده قوی تر از کربن هستند، بنابراین، زمانی که گرما، فلزات حاصل می شود اکسیداسیون کردن کربن بیش از حد، دادن کاربید:

اکسید کربن (II).
در صورت اکسیداسیون ناقص کربن، مونوکسید کربن (II) تشکیل شده است - مونوکسید کربن. در آب او محلول نیست. درجه رسمی اکسیداسیون کربن 2+ ساختار مولکول CO را منعکس نمی کند. در مولکول CO، علاوه بر پیوند دوگانه تشکیل شده توسط تعمیم الکترون های کربن و اکسیژن، یک اتصال اضافی، سوم (به تصویر کشیده شده توسط یک فلش) تشکیل شده توسط یک مکانیزم گیرنده کمک کننده به دلیل جفت الکترون های الکترونهای اکسیژن وجود دارد :در ارتباط با این، مولکول بسیار با دوام است. اکسید کربن (II) غیر تشکیل است و تحت شرایط عادی با آب، اسیدها و قلیایی ارتباط ندارد. در دمای بالا، به واکنش به پیوستن و بازیابی اکسیداسیون متصل می شود. در شرکت هوا با شعله آبی سوزانده می شود:
![]()
این فلزات را از اکسید خود بازسازی می کند:
![]()
تحت تاثیر تابش در نور مستقیم خورشید و یا در حضور کاتالیزورها با ارتباط با
CL 2 تشکیل phosgene - گاز بسیار سمی:![]()
در ماهیت اکسید کربن (II) عملا یافت نمی شود.
این را می توان با کم آبی بدن اسید فرمیک تشکیل داد (روش آزمایشگاهی برای به دست آوردن):![]()
بر اساس آخرین تحول کاملا رسمیمی تواند در نظر گرفته شود آنیدرید، اسید فرمیک. این توسط واکنش زیر تایید شده است، که زمانی اتفاق می افتد که CO به ذوب قلیایی در فشار بالا منتقل می شود:
کربنیل های انتقال فلزات.
با بسیاری از فلزات با شکل گیری فرار کربنیل ها:ارتباطات کووالانتی
ni- C در مولکول کربنیل نیکل بر اساس مکانیزم کمک کننده اهدا کننده تشکیل شده است و تراکم الکترون از اتم کربن به اتم نیکل منتقل می شود. افزایش شارژ منفی بر روی اتم فلزی توسط مشارکت الکترونهای D آن در ارتباط جبران می شود، بنابراین درجه اکسیداسیون فلزی 0. هنگامی که کربونیل های فلزی حرارتی بر روی فلز و مونوکسید کربن (II) تجزیه می شوند، که به آن استفاده می شود به دست آوردن فلزات خلوص ویژه.اکسید کربن (IV). اکسید کربن (IV) عصبی اسید زغال سنگ است
2 CO 3. و دارای تمام خواص اکسید اسیدی است.در طول انحلال
CO 2. در آب، اسید آکوستیک تا حدی تشکیل شده است، در حالی که در محلول تعادل زیر وجود دارد:وجود تعادل با این واقعیت توضیح داده شده است که اسید آکواریک اسید بسیار ضعیف است (به
1 = 4H 10 -7، به 2 = 5H 10 -11 در دمای 25 درجه سانتیگراد). در فرم آزاد اسید آکوستیک ناشناخته، به عنوان ناپایدار و به راحتی تجزیه شده است.اسید کربنیک. در مولکول اسید آکوستیک، اتم های هیدروژن با اتم های اکسیژن همراه است:
به عنوان یک دوسالانه یک دوسالانه از بین رفته است. اسید اکوسیک به الکترولیت های ضعیف اشاره دارد.
اسید آکوستیک به عنوان یک نمک دو محور نمک متوسط \u200b\u200b- کربناتها و نمک های ترش - بی کربنات.واکنش با کیفیت بالا به این نمک، اثر اسیدهای قوی است. با این واکنش، اسید زغال سنگ از نمک های خود آواره شده و با انتخاب تجزیه می شود دی اکسید کربن:
نمک اسید کربنیک.
سودا Na 2 CO 3 دارای بیشترین اهمیت عملی اسید آکوستیک است . این نمک چندین کریستال هیدرات را تشکیل می دهد که از آن پایدار ترین استna 2 co 3 H 10H 2 O(نوشابه کریستالی). هنگامی که کالسیدن نوشابه های کریستالی بدون آب به دست می آید یا محاسبه شده، سودا na 2 co 3 . به طور گسترده ای نیز استفاده می شود نوشابه nah co 3. . از نمک های فلزات دیگر مهم هستند:K 2 CO 3 ( پتاس) - پودر سفید، به خوبی محلول در آب، در خاکستر گیاهان موجود است، در تولید صابون مایع، شیشه های نسوز نوری، رنگدانه ها استفاده می شود؛ CA 3 (سنگ آهک) - این در طبیعت به شکل سنگ مرمر، گچ و سنگ آهک یافت می شود که در کسب و کار ساخت و ساز استفاده می شود. این لیمو و اکسید کربن را دریافت می کند ( iv)کپی رایت © 2005-2013 Xenoid V2.0
استفاده از مواد سایت امکان ارائه لینک فعال را فراهم می کند
شایع ترین دانش سه حالت کلی رایج ترین موارد است: مایع، جامد، گاز، گاهی اوقات پلاسما، کریستال کمتر مایع را به یاد می آورد. آخرین بار در اینترنت لیستی از 17 فاز از مواد گرفته شده از شناخته شده () Stephen Fry وجود دارد. بنابراین، ما در مورد آنها جزئیات بیشتری خواهیم گفت، زیرا در مورد ماده باید حداقل حداقل حداقل بدانید تا فرایندهای موجود در جهان را بهتر درک کنید.
لیست حالت های جمع شده ذکر شده در زیر افزایش یافته از سردترین حالت ها به داغترین و غیره ممکن است ادامه یابد در عین حال، باید آن را از یک دولت گازدار (№11)، درجه فشرده سازی ماده و فشار آن (با برخی از رزرو برای چنین حالت های فرضی غیر منتظره، به عنوان یک کوانتومی، تابش یا متقارن ضعیف)، درک شود. یک نمودار بصری از انتقال فاز ماده داده شده است.
1. کوانتوم - حالت کل ماده ماده ای که با کاهش دمای به صفر مطلق به دست می آید، به عنوان یک نتیجه از ارتباطات داخلی و ماده ناپدید می شود و مسائل مربوط به کوارک های آزاد است.
2. انیشتین باسنستر - حالت جامد ماده، بر اساس آن بوزون ها به دمای نزدیک به صفر مطلق خنک می شوند (کمتر از میلیون ها درجه بالاتر از صفر مطلق). در چنین حالت قوی خنک، تعداد زیادی از اتم ها به نظر می رسد که در حالت های کوانتومی حداقل ممکن است و اثرات کوانتومی شروع به آشکار شدن خود در سطح ماکروسکوپی می شود. مخلوط انیشتاین (که اغلب به نام "مایع بوز" نامیده می شود، یا به سادگی "پشت") زمانی اتفاق می افتد زمانی که شما یک یا یک عنصر شیمیایی را به دمای بسیار پایین (به عنوان یک قاعده، به درجه حرارت کمی بالاتر از صفر مطلق، منفی 273 درجه سانتیگراد - درجه حرارت نظری که در آن همه چیز متوقف می شود).
در اینجا، با یک ماده، چیزهای کاملا عجیب و غریب شروع می شود. فرآیندهای معمولا در سطح اتم ها مشاهده می شود، اکنون به اندازه کافی بزرگ می شود تا چشم غیر مسلح را مشاهده کنند. به عنوان مثال، اگر شما "عقب" را به شیشه آزمایشگاهی قرار دهید و رژیم دمای مورد نظر را تهیه کنید، این ماده شروع به خزیدن دیوار می کند و در نهایت خود را در خارج انتخاب می شود.
ظاهرا، در اینجا ما با تلاش بیهوده برای کاهش انرژی خودمان (که در حال حاضر در پایین ترین سطح ممکن است) برخورد می کنیم.
کاهش اتم ها با استفاده از تجهیزات خنک کننده اجازه می دهد تا شما را به یک حالت کوانتومی منحصر به فرد، شناخته شده به عنوان بوزان مایع، یا بوز - انیشتین. این پدیده در سال 1925 توسط A. انیشتین پیش بینی شده بود، به عنوان یک نتیجه از تعمیم کار S. bose، جایی که مکانیک آماری برای ذرات ساخته شد، اعم از فوتونو بیسیم برای داشتن توده اتم ها (نسخه خطی انیشتین، در نظر گرفته شده از دست رفته، در سال 2005 در کتابخانه دانشگاه لیدن کشف شد). نتیجه تلاش های بوز و انیشتین، مفهوم بوز بوز به آمار بوز - انیشتین وابسته بود، که توزیع آماری ذرات یکسان را با یک چرخش کامل، به نام بوزون توصیف می کند. بوزون ها، به عنوان مثال، ذرات ابتدایی فردی - فوتون ها و کل اتم ها می توانند با یکدیگر در حالت های یکسان کوانتومی باشند. انیشتین پیشنهاد کرد که خنک کننده اتم ها - بوزون ها به دمای بسیار پایین آنها را مجبور به رفتن (یا به شیوه ای متفاوت، محدود کردن) به کمترین حالت کوانتومی ممکن می کند. نتیجه چنین تراکم، وقوع یک نوع جدید از یک ماده است.
این انتقال زیر دمای بحرانی رخ می دهد که برای گاز سه بعدی همگن، متشکل از ذرات غیر مصرفی بدون هیچ گونه درجه آزادی داخلی است.
3. منسوجات فامر - یک حالت جامد ماده ای شبیه به BEC، اما در ساختار متفاوت است. هنگامی که نزدیک شدن به صفر مطلق، اتم ها به طور متفاوتی به اندازه لحظه ای از حرکت خود (چرخش) رفتار می کنند. بوزون های پشت دارای مقادیر عدد صحیح هستند و در فرم ها - چند برابر 1/2 (1/2، 3/2، 5/2). فرمیون ها به اصل ممنوعیت پولس تحت تاثیر قرار می گیرند، طبق آن دو فرمه نمی توانند همان وضعیت کوانتومی را داشته باشند. چنین ممنوعیت برای بوزون وجود ندارد، و به همین دلیل آنها فرصت دارند تا در یک حالت کوانتومی وجود داشته باشند و به این ترتیب، انیشتین بوز به اصطلاح را تشکیل می دهند. روند آموزش این تراکم مسئول انتقال به حالت ابررسانایی است.
الکترون ها دارای یک چرخش 1/2 هستند و بنابراین متعلق به فرم ها هستند. آنها به جفت ها (به اصطلاح جفت کوپر) ترکیب می شوند که پس از آن میعانات بوز را تشکیل می دهند.
دانشمندان آمریکایی تلاش کردند تا نوع مولکول ها را از اتم های منفرد با خنک شدن عمیق بدست آورند. تفاوت از مولکول های واقعی این بود که هیچ پیوند شیمیایی بین اتم ها وجود نداشت - آنها به سادگی با هم حرکت کردند، همبستگی داشتند. رابطه بین اتم ها حتی قوی تر از بین الکترون ها در جفت های کوپر بود. در زوج های فرمیونی تشکیل شده، چرخش کل دیگر کیتی 1/2 نیست، بنابراین، آنها در حال حاضر مانند بوزون ها رفتار می کنند و می توانند یک مایع بوز را با یک حالت کوانتومی تشکیل دهند. در طول آزمایش، گاز از اتم های پتاسیم 40 تا 300 نانوسلولین خنک شد، در حالی که گاز به اصطلاح تله نوری بود. سپس یک میدان مغناطیسی خارجی را تحمیل کرد، که ممکن بود طبیعت تعاملات بین اتم ها را تغییر دهید - به جای انفجار شدید، جاذبه قوی مشاهده شد. هنگام تجزیه و تحلیل تاثیر میدان مغناطیسی، ممکن بود این مقدار را پیدا کنید که در آن اتم ها شروع به رفتار مانند جفت الکترون های کوپر کردند. در مرحله بعدی آزمایش، دانشمندان پیشنهاد می کنند تا اثرات ابررسانایی را برای تراکم فامر به دست آورند.
4. Superfluid ماده - شرایطی که ماده در واقع ویسکوزیته ندارد، و در طول جریان، اصطکاک را با یک سطح جامد تجربه نمی کند. نتیجه این امر، به عنوان مثال، چنین اثر جالبی، به عنوان یک "خزنده کامل" خود به خود از هلیوم فوقالعاده از کشتی در امتداد دیوارهای آن در برابر گرانش است. نقض قانون حفاظت از انرژی در اینجا، البته، نه. در غیاب نیروهای اصطکاک بر هلیوم، تنها نیروهای گرانشی، نیروهای تعامل بین اتمی بین هلیوم و دیواره های کشتی و بین اتم های هلیوم وجود دارد. بنابراین، نیروهای تعامل بین اتمی بیش از همه نیروهای دیگر با هم هستند. به عنوان یک نتیجه، هلیوم تلاش می کند تا هرچه ممکن است در تمام سطوح ممکن رشد کند، بنابراین "سفر" در امتداد دیوارهای کشتی است. در سال 1938، دانشمند شوروی پیتر کاپیتسا ثابت کرد که هلیوم می تواند در یک حالت فوقالعاده وجود داشته باشد.
شایان ذکر است که بسیاری از خواص غیر معمول هلیوم به مدت طولانی شناخته شده اند. با این حال، در سال های اخیر، این عنصر شیمیایی "استخر" اثرات جالب و غیر منتظره است. بنابراین، در سال 2004، موسی چان و یون-آهنگ کیم از دانشگاه پنسیلوانیا، دنیای علمی را با بیانیه ای که آنها موفق به دریافت یک حالت کاملا جدید از هلیوم - سوپر فلوئید جامد مواد جامد شدند. در این حالت، برخی از اتم های هلیوم در یک شبکه کریستال می توانند به دیگران آموزش دهند و هلیوم به گونه ای می تواند از طریق خود جریان یابد. اثر "Superterability" به لحاظ نظری پیش بینی شده در سال 1969 بود. و در سال 2004 - به عنوان اگر تایید تجربی. با این حال، آزمایش های بعد و بسیار کنجکاو نشان داده اند که همه چیز خیلی ساده نیست، و شاید چنین تفسیری از پدیده، که قبل از آن برای superfluidic از هلیوم جامد گرفته شده، نادرست است.
آزمایش دانشمندان تحت رهبری همفری ماریزا از دانشگاه براون در ایالات متحده ساده و ظریف بود. دانشمندان در پایین لوله آزمایش قرار گرفتند به مخزن بسته با هلیوم مایع. بخشی از هلیوم در لوله و در مخزن آنها به گونه ای یخ زده بود که مرز بین مایع و سخت در داخل لوله آزمایش بالاتر از مخزن بود. به عبارت دیگر، در قسمت بالای لوله آزمایش، یک هلیوم مایع بود، در پایین تر، به سختی به فاز جامد تانک منتقل شد، که طی آن یک هلیوم مایع کمی ریخته شد - کمتر از سطح مایع بود لوله. اگر لیوم مایع شروع به نشت از طریق جامد، پس از آن تفاوت سطح کاهش می یابد، و سپس ما می توانیم در مورد هلیوم Superfluid سخت صحبت کنیم. و در اصل، در سه آزمایش 13، تفاوت در سطوح واقعا کاهش یافت.
5. ماده برتر - حالت جامد که در آن ماده شفاف است و می تواند "جریان" به عنوان مایع باشد، اما در واقع آن را از بین می رود. چنین مایعات برای سالهای زیادی شناخته شده است، آنها Superfludes نامیده می شوند. واقعیت این است که اگر سرکش سرکش شود، تقریبا ابدی را گردش می دهد، در حالی که مایع طبیعی در نهایت آرام خواهد شد. دو سوپر فلفل اول توسط محققان با استفاده از هلیوم 4 و هلیوم 3 ایجاد شد. آنها تقریبا به صفر مطلق خنک شدند - تا منهای 273 درجه سانتیگراد. و از هلیوم 4 دانشمندان آمریکایی موفق به دریافت یک بدن فوق العاده ای شدند. هلیوم منجمد آنها فشار بیش از 60 بار فشار داده شد، و سپس یک شیشه ای پر از ماده به یک دیسک چرخشی تنظیم شد. در دمای 0.175 درجه سانتیگراد، دیسک به طور ناگهانی شروع به چرخش آزادانه کرد، که به گفته دانشمندان، نشان می دهد که هلیوم فوق العاده فوق العاده است.
6. سخت - حالت جامد ماده، متفاوت در پایداری شکل و شخصیت حرکت حرارتی اتم هایی است که نوسانات کوچک را در اطراف موقعیت های تعادل ایجاد می کنند. حالت پایدار بدن جامد بلورین است. مواد جامد با یونی، کووالانسی، فلز و سایر انواع ارتباطات بین اتم ها وجود دارد که موجب خواص فیزیکی آنها می شود. الکتریکی و برخی از خواص دیگر بدن های جامد عمدتا توسط ماهیت حرکت الکترون های خارجی اتم های آن تعیین می شود. با خواص الکتریکی، بدن های جامد به دی الکتریک، نیمه هادی ها و فلزات، مغناطیسی - بر روی Diamagnetics، پارامغناطیس و بدن با ساختار مغناطیسی مرتب تقسیم می شوند. مطالعات بدنه های جامد به منطقه بزرگ تبدیل شده اند - فیزیک جامد، توسعه آن توسط نیازهای تکنولوژی تحریک می شود.
7. سخت آمورف - یک حالت جامد تراکم ماده ای که توسط ایزوتراپی خواص فیزیکی ناشی از محل اختلال اتم ها و مولکول ها مشخص شده است. در جامدات آمورف، اتم ها در مورد نقاط هرج و مرج نوسان می کنند. در مقایسه با حالت بلوری، انتقال از آمورف جامد به مایع به تدریج رخ می دهد. در حالت آمورف، مواد مختلفی وجود دارد: شیشه، رزین، پلاستیک، و غیره
8. کریستال مایع - این یک ماده جامد خاص جامد است که در آن به طور همزمان خواص کریستال و مایع را نشان می دهد. بلافاصله لازم است که به نوبه خود این کار را نکنیم نه همه مواد می توانند در حالت کریستال مایع باشند. با این حال، برخی از مواد آلی با مولکول های پیچیده می توانند یک کل کریستال مایع را تشکیل دهند. این شرایط هنگام ذوب کریستال های برخی از مواد انجام می شود. هنگامی که آنها ذوب می شوند، فاز کریستال مایع از مایعات معمولی متفاوت است. این فاز در فاصله زمانی از نقطه ذوب کریستال به دمای مشخصی بالاتر وجود دارد، زمانی که گرمایی که کریستال مایع به مایع طبیعی می رود، گرم می شود.
کریستال مایع از مایع و کریستال معمولی متفاوت است و آنچه شبیه به آنها است چیست؟ مثل یک مایع معمولی، کریستال مایع مایع است و شکل کشتی را می گیرد که در آن قرار دارد. این از کریستال های معروف متفاوت است. با این حال، علیرغم این اموال، ترکیب آن با استخوان مایع، دارای ویژگی اموال کریستال است. این سفارش در فضای مولکول های تشکیل کریستال است. درست است که این سفارش کامل کامل نیست، همانطور که در کریستال های معمولی کامل نیست، اما، با این وجود، آن را به طور قابل توجهی بر خواص بلورهای مایع تاثیر می گذارد و آنها را از مایعات معمولی متمایز می کند. دستورالعمل ناقص رشته ای از مولکول های تشکیل شده از مولکول های تشکیل یک کریستال مایع در این واقعیت نشان می دهد که در بلورهای مایع هیچ نظم کامل در محدودیت فضایی مراکز شدت مولکول وجود ندارد، هرچند که مرتبه جزئی می تواند باشد. این به این معنی است که آنها هیچ شبکه ای از فولاد سفت و سخت ندارند. بنابراین، کریستال های مایع، مانند مایعات متعارف، دارایی مایع هستند.
مالکیت اجباری کریستال های مایع، آنها را با بلورهای معمولی حباب می کند، وجود یک جهت گیری فضایی مولکول ها است. به عنوان مثال، چنین نظم در جهت گیری ممکن است ظاهر شود، در این واقعیت که تمام محورهای طولانی مولکول ها در نمونه کریستال مایع به طور مساوی گرا هستند. این مولکول ها باید یک فرم بلند داشته باشند. علاوه بر ساده ترین سفارش محورهای مولکول، یک نظم پیچیده تر از مولکول ها را می توان در یک کریستال مایع انجام داد.
بسته به نوع سفارش محورهای مولکول، کریستال های مایع به سه نوع تقسیم می شوند: نایماتیک، پیچیده و کلستریک.
مطالعات فیزیک کریستال های مایع و اعلامیه های آنها در حال حاضر به طور گسترده ای در تمام کشورهای توسعه یافته جهان منتشر شده است. مطالعات داخلی بر روی هر دو موسسه تحقیقاتی دانشگاهی و بخش متمرکز شده و سنت های طولانی دارند. شهرت عالی و شناخت دریافت شده در سی سالگی در لنینگراد V.K. frederix به v.n. Tsvetkov. در سال های اخیر، مطالعه سریع کریستال های مایع، محققان داخلی نیز سهم قابل توجهی در توسعه آموزه های کریستال های مایع به طور کلی و به ویژه در اپتیک های کریستال های مایع می کنند. بنابراین، کار I.G. Chistyakova، A.P. Kapustina، S.A. Brazovsky، S.A. Pikina، L.M. Blinov و بسیاری از مطالعات تحقیقاتی شوروی به طور گسترده ای به جامعه علمی شناخته شده اند و به عنوان پایه ای از تعدادی از کاربردهای فنی مؤثر کریستال های مایع استفاده می شود.
وجود کریستال های مایع برای مدت زمان بسیار طولانی، یعنی در سال 1888، یعنی تقریبا یک قرن پیش تاسیس شد. اگر چه دانشمندان تا سال 1888 در این حالت ماده آمده اند، اما بعدا رسما آن را باز کرده اند.
اولین کسانی که کریستال های مایع را کشف کردند، دانشمند بوتیک-ریاضی بوتیک-ریاضی بود. کاوش در مورد یک ماده جدید X-Dishesized Cholesterolbenzoate، نشان داده شده است که در دمای 145 درجه سانتیگراد، کریستال ها ذوب می شوند، تشکیل یک مایع نور شدید به شدت پراکنده می شوند. هنگامی که گرمایش همچنان به دمای 179 درجه سانتیگراد می رسد، مایع روشن است، به عنوان مثال، شروع به رفتار در نگرش نوری، به عنوان یک مایع معمولی، به عنوان مثال آب. خواص غیر منتظره کلسترولبنزوات در فاز کثیف یافت می شود. با توجه به این مرحله تحت میکروسکوپ قطبی شدن، Rei-Nitzer کشف کرد که دارای یک اتصال است. این به این معنی است که شاخص انکساری نور، I.E. سرعت نور این فاز بستگی به قطبش دارد.
9. مایع - یک حالت جامد ماده ای است که ویژگی های یک حالت جامد را ترکیبی می کند (حفظ حجم، یک قدرت کششی خاص) و گازی (تغییر شکل). مایع با سفارش نزدیک در محل ذرات (مولکول ها، اتم ها) و یک تفاوت کوچک در انرژی جنبشی حرکت حرارتی مولکول ها و انرژی متقابل بالقوه آنها مشخص می شود. حرکت حرارتی مولکول های مایع شامل نوسانات در نزدیکی موقعیت های تعادلی و جهش های نسبتا نادر از یک موقعیت تعادل به دیگری است، میزان جریان سیال متصل است.
10. مایع فوق بحرانی (SCF) - حالت کل ماده ماده ای که در آن تمایز بین فاز مایع و گاز ناپدید می شود. هر ماده ای که در دمای و فشار بالاتر از نقطه بحرانی است، یک مایع فوق بحرانی است. خواص ماده در حالت فوق بحرانی بین خواص آن در فاز گاز و مایع. بنابراین، SCF دارای تراکم بالا نزدیک به مایع و ویسکوزیته کم و همچنین گازها است. ضریب انتشار در همان زمان دارای متوسط \u200b\u200bبین مقدار مایع و گاز است. مواد موجود در حالت فوق بحرانی می توانند به عنوان جایگزین های حلال های آلی در فرایندهای آزمایشگاهی و صنعتی استفاده شوند. آب فوق بحرانی و دی اکسید کربن فوق بحرانی بیشترین علاقه و توزیع را به دلیل خواص خاص به دست آورد.
یکی از مهمترین خواص حالت فوق بحرانی، توانایی حل کردن مواد است. تغییر دما یا فشار مایع را می توان خواص آن را در طیف گسترده ای تغییر داد. بنابراین، شما می توانید یک مایع، توسط خواص نزدیک یا مایع، یا گاز دریافت کنید. بنابراین، ظرفیت حل شدن مایع با افزایش تراکم (با دمای ثابت) افزایش می یابد. از آنجایی که تراکم با افزایش فشار افزایش می یابد، سپس تغییر فشار را می توان تحت تأثیر توانایی حل شدن مایع (در دمای ثابت) قرار داد. در مورد درجه حرارت، حسادت از خواص مایع تا حدودی پیچیده تر است - با تراکم ثابت، حلال مایع نیز افزایش می یابد، اما در نزدیکی یک نقطه بحرانی، افزایش دمای جزئی می تواند منجر به افت شدید تراکم شود، و، بر این اساس، توانایی حل شدن. مایعات فوق بحرانی با یکدیگر کاملا مخلوط می شوند، بنابراین هنگامی که نقطه بحرانی مخلوط رسیده است، سیستم همیشه تک فاز خواهد بود. دمای تقریبی بحرانی مخلوط باینری را می توان به عنوان میانگین ریاضی پارامترهای بحرانی مواد TC (MIX) \u003d (قطر مولر a) X TCA + (کسر مولکول B) X TCB محاسبه کرد.
11. گازی - (فرانتز گاز، از یونانی. هرج و مرج - هرج و مرج)، یک حالت جامد از ماده ای که در آن انرژی جنبشی حرکت حرارتی ذرات آن (مولکول ها، اتم ها، یون ها) به طور قابل توجهی بیش از انرژی بالقوه تعاملات بین آنها است، و در ارتباط با آن ذرات آزادانه حرکت می کنند، به طور مساوی در غیاب زمینه های خارجی تمام حجم ارائه شده به آنها را پر می کنند.
12. پلاسما - (از یونانی. پلاسما - مسطح، تزئین شده)، وضعیت ماده ای که نشان دهنده گاز یونیزه است، که در آن غلظت اتهامات مثبت و منفی برابر با (شبه بی طرفی) است. در حالت پلاسما بخش قریب به اتفاق از ماده جهان وجود دارد: ستاره ها، سحابی های کهکشانی و رسانه بین ستاره ای. در نزدیکی زمین پلاسما در قالب باد خورشیدی، مغناطیسفر و یونوسفر وجود دارد. پلاسما با درجه حرارت بالا (T ~ 106 - 108K) از مخلوطی از دوتریوم و تریتیوم برای پیاده سازی سنتز حرارتی کنترل شده مورد بررسی قرار گرفته است. پلاسمای کم دما (T ј 105K) در دستگاه های مختلف تخلیه گاز (لیزر گاز، دستگاه های یونی، ژنراتورهای MHD، مشعل های پلاسما، موتورهای پلاسما، و غیره) و همچنین در تکنیک استفاده می شود (متالورژی پلاسما، حفاری پلاسما را ببینید ، تکنولوژی پلاسما).
13. ماده دژنراسیون - این یک مرحله متوسط \u200b\u200bبین پلاسما و نوترونیم است. این در کوتوله های سفید مشاهده می شود، نقش مهمی در تکامل ستاره ها ایفا می کند. هنگامی که اتم ها در شرایط دمای بالا و فشارهای بسیار بالا هستند، الکترون های خود را از دست می دهند (آنها به گاز الکترونیکی می روند). به عبارت دیگر، آنها به طور کامل یونیزه شده اند (پلاسما). فشار این گاز (پلاسما) با فشار الکترونها تعیین می شود. اگر تراکم بسیار زیاد باشد، تمام ذرات مجبور به نزدیک شدن به یکدیگر هستند. الکترونها می توانند در ایالات متحده با انرژی های خاصی باشند و دو الکترون نمیتوانند انرژی مشابهی داشته باشند (مگر اینکه پشت آنها مخالف باشند). بنابراین، در گاز متراکم، تمام سطوح پایین انرژی با الکترون ها پر می شود. چنین گاز به نام Degenerate نامیده می شود. در این حالت، الکترونها فشار الکتریکی دژنراتی را نشان می دهند که نیروهای گرانشی را مقابله می کنند.
14. نوترونیم - یک حالت جامد که در آن ماده با فشار فوق العاده بالا، غیر قابل دسترس در آزمایشگاه، اما در داخل ستاره های نوترونی عبور می کند. هنگام رفتن به حالت نوترون، الکترون های ماده با پروتون ها ارتباط برقرار می کنند و به نوترون ها تبدیل می شوند. در نتیجه، ماده در حالت نوترون کاملا متشکل از نوترون ها است و چگالی نظم هسته ای دارد. دمای ماده نباید بیش از حد بالا باشد (در معادل انرژی بیش از صد MEV).
با افزایش شدید درجه حرارت (صدها نفر از MEV و بالاتر)، حالت نوترونی شروع به تولد و نابود کردن انواع Mesons می کند. با افزایش بیشتر درجه حرارت، دکوراسیون ها رخ می دهد، و ماده به حالت پلاسمای کوارک-گلوون منتقل می شود. این دیگر از هادرون نیست، بلکه از کوارک ها و گلوله های دائمی متولد شده و ناپدید می شود.
15. پلاسما کوارک-گلوون (Chromoplasm) یک حالت جامد ماده در فیزیک با انرژی بالا و فیزیک ذرات ابتدایی است که در آن ماده اینترنال به حالت مشابه دولت می رسد که در آن الکترون ها و یون ها در یک پلاسما معمولی قرار دارند.
معمولا ماده در Adrones در حالت به اصطلاح بی رنگ ("سفید") است. یعنی کوارک های رنگ های مختلف یکدیگر را جبران می کنند. یک وضعیت مشابه و در ماده متعارف وجود دارد - زمانی که تمام اتم ها از لحاظ الکتریکی خنثی هستند، یعنی
اتهامات مثبت برای منفی جبران می شود. در دمای بالا، یونیزاسیون اتم ها ممکن است رخ دهد، در حالی که اتهامات جدا شده است، و این ماده، همانطور که می گویند، "شبه خنثی" می شود. به عبارت دیگر، خنثی کل ابر ماده را به طور کلی باقی می ماند و ذرات فردی آن خنثی هستند تا متوقف شوند. به همین ترتیب، ظاهرا، می تواند با ماده نیازمند - با انرژی های بسیار بالا رخ دهد، رنگ به آزادی می رسد و ماده "quasi-color" را می سازد.
احتمالا، ماده جهان در اولین لحظات پس از انفجار بزرگ، یک پلاسمای کوارک-گلوون بود. در حال حاضر پلاسمای کوارک-گلوون ممکن است برای مدت کوتاهی با برخورد ذرات انرژی بسیار زیاد تشکیل شود.
پلاسمای کوارک گلوون به صورت آزمایشی در شتاب دهنده آزمایشگاه ملی RHIC Brookhaven در سال 2005 به دست آمد. حداکثر دمای پلاسما 4 تریلیون درجه سانتیگراد در فوریه 2010 به دست آمد.
16. ماده عجیب و غریب - یک حالت جامد که در آن ماده به منظور محدود کردن مقادیر چگالی فشرده شده است، ممکن است در قالب سوپ کوارک وجود داشته باشد. سانتیمتر مکعب ماده در این حالت میلیاردها تن وزن خواهد کرد؛ علاوه بر این، هر ماده نرمال را که در تماس با همان فرم "عجیب و غریب" با مقدار قابل توجهی از انتشار انرژی، تبدیل خواهد شد.
انرژی که می تواند زمانی که ماده هسته ستارگان در "ماده عجیب و غریب" منجر به انفجار فوق العاده قدرت "تقصیر"، و، به گفته Lyha و هود، آن را ستاره شناسان خود را در سپتامبر 2006 و تماشای آن است.
فرآیند تشکیل این ماده با ابرنواختر معمولی آغاز شد، که در آن یک ستاره عظیم تبدیل شد. به عنوان یک نتیجه از اولین انفجار، یک ستاره نوترونی تشکیل شد. اما، با توجه به Lyha و هود، آن را برای آن بسیار طولانی وجود داشت، - به عنوان چرخش او به نظر می رسید که توسط میدان مغناطیسی خود کاهش می یابد، او شروع به کاهش حتی قوی تر، با تشکیل یک ساعت "ماده عجیب و غریب"، که منجر شد به جای انفجار معمول ابرنواختر، انتشار انرژی - و لایه های خارجی ماده ستاره نوترونی سابق، که به سرعت نزدیک به سرعت نور پرواز کرد، به جای انفجار معمولی، به جای آن قوی تر، به جای آن با انفجار انرژی - و لایه های خارجی است.
17. مواد بسیار متقارن - این ماده فشرده شده به اندازه ای که در آن microparticles در داخل آن بر روی یکدیگر قرار می گیرند، و بدن خود را در سیاهچاله فرو می ریزد. اصطلاح "تقارن" به شرح زیر توضیح داده شده است: ایالت های جمع آوری شده برای همه افراد با نیمکت مدرسه - جامد، مایع، گازی را انتخاب کنید. برای دفاعی به عنوان یک ماده جامد، کریستال بی نهایت کامل را در نظر بگیرید. این یک تقارن خاص، به اصطلاح گسسته در مورد انتقال وجود دارد. این به این معنی است که اگر شما شبکه کریستال را در فاصله ای برابر با فاصله بین دو اتم حرکت دهید، هیچ چیز در آن تغییر نخواهد کرد - کریستال با آن همخوانی دارد. اگر کریستال ذوب شود، تقارن مایع ناشی از آن متفاوت خواهد بود: افزایش خواهد یافت. در کریستال، تنها نقاط حذف شده از یکدیگر، برابر با فاصله های خاصی بودند، کلیدهای به اصطلاح کریستالی که در آن اتم های یکسان وجود داشت.
مایع در سراسر حجم یکنواخت است، تمام نقاط آن یکی از موارد غیر قابل تشخیص است. این به این معنی است که مایعات را می توان به هر فاصله دلخواه (و نه تنها بر روی برخی گسسته، مانند یک کریستال) تغییر داد یا هر زاویه دلخواه را روشن کرد (که نمی تواند در همه کریستال ها انجام شود) و آن را با آن هماهنگ خواهد شد. درجه تقارن او بالاتر است. گاز حتی بیشتر متقارن است: مایع دارای حجم خاصی در کشتی است و عدم تقارن در داخل کشتی مشاهده می شود، جایی که مایع وجود دارد، جایی که یک مایع وجود دارد و نقاطی که در آن نیست. گاز تمام حجم ارائه شده به او را اشغال می کند، و در این راستا تمام نقاط آن از یکدیگر غیر قابل تشخیص نیستند. با این وجود، در اینجا بهتر خواهد بود که در مورد نقاط صحبت نکنیم، اما در مورد عناصر کوچک، اما ماکروسکوپی، زیرا هنوز در سطح میکروسکوپی وجود دارد. در یک لحظه در حال حاضر اتم ها یا مولکول ها وجود دارد و هیچ کس دیگری وجود ندارد. تقارن تنها به طور متوسط \u200b\u200bیا بر اساس برخی از حجم پارامتر ماکروسکوپی یا زمان مشاهده می شود.
اما تقارن فوری در سطح میکروسکوپی هنوز هنوز رتبهدهی نشده است. اگر ماده بسیار فشرده شده باشد، فشارهایی که در استفاده غیر قابل قبول هستند، فشرده می شوند، به طوری که اتم ها خرد شده بودند، پوسته های آنها به یکدیگر نفوذ کردند، و هسته شروع به لمس کرد، تقارن بر روی سطح میکروسکوپی رخ می دهد. تمام هسته ها یکسان هستند و به یکدیگر فشار می آورند، نه تنها فواصل بینایی، بلکه همچنین فاصله های بینابینی نیز وجود دارد و ماده یک همگن (ماده عجیب و غریب) می شود.
اما هنوز هم یک سطح زیر میکروسکوپی وجود دارد. هسته شامل پروتون ها و نوترون هایی است که در داخل هسته حرکت می کنند. بین آنها نیز نوعی فضا وجود دارد. اگر شما همچنان به فشرده سازی ادامه دهید تا هسته ها خرد شوند، هسته ها به یکدیگر متصل می شوند. سپس تقارن، که حتی در داخل هسته های معمول نیست، در سطح submicroscopic ظاهر می شود.
از بالا، شما می توانید یک گرایش کاملا قطعی را ببینید: بالاتر از درجه حرارت و فشار بیشتر، متقارن بیشتر به ماده تبدیل می شود. بر اساس این ملاحظات، ماده به حداکثر اندازه گیری شده است، به شدت متقارن نامیده می شود.
18. ماده متقارن ضعیف - دولت مخالف یک ماده قوی متقارن با توجه به خواص آن، که در یک جهان بسیار زود هنگام در دمای نزدیک به پلانک وجود داشت، شاید بعد از 10 تا 12 ثانیه پس از انفجار بزرگ، زمانی که نیروهای قوی، ضعیف و الکترومغناطیسی توسط یک فرد فوق العاده در این حالت، این ماده به گونه ای فشرده شده است که توده آن به انرژی تبدیل می شود که به آنفولانزا شروع می شود، یعنی گسترش به طور نامحدود. برای رسیدن به انرژی برای آماده سازی تجربی Supersila و انتقال ماده در این مرحله در شرایط زمین، غیرممکن است، هرچند چنین تلاش هایی بر روی یک Collider بزرگ هادرون به منظور مطالعه جهان اولیه انجام شد. با توجه به عدم وجود مشترک، تشکیل این ماده، تعامل گرانشی، Supersila در مقایسه با نیروی فوق العاده ای که حاوی تمام 4 نوع تعاملات است، به اندازه کافی متقارن نیست. بنابراین، این دولت جمع شده و چنین نامی را دریافت کرد.
19. Raewy ماده - این اساسا یک ماده نیست، بلکه در انرژی خالص آن است. با این حال، این حالت جمع آوری شده فرضیه بدن را که به سرعت نور رسیده است، می گیرد. همچنین می توان به دست آورد، گرم کردن بدن به دمای پانک (1032K)، یعنی گرم کردن مولکول ماده به سرعت نور. به شرح زیر از نظریه نسبیت، زمانی که سرعت به بیش از 0.99 ثانیه رسیده است، وزن بدن شروع به رشد سریع تر از شتاب "معمول"، علاوه بر این، بدن طول می کشد، گرم، یعنی، شروع به کار می کند در طیف مادون قرمز منتشر می شود. هنگامی که آستانه متقاطع است، 0.999 ثانیه، بدن به طور اساسی اصلاح می شود و شروع به انتقال سریع فاز تا زمانی که حالت تابش است. به شرح زیر از فرمول انیشتین، به طور کامل گرفته شده، توده رو به رشد مواد نهایی از توده های جدا شده از بدن جدا شده از بدن جدا شده از بدن، اشعه ایکس، اشعه نوری و دیگر، انرژی هر کدام از آنها است توسط عضو زیر در فرمول شرح داده شده است. بنابراین، بدن به سرعت نور نزدیک می شود، در تمام طیف ها تابش می شود، در طول زمان رشد می کند، در طول زمان رشد می کند و به طول پانل کاهش می یابد، یعنی هنگامی که رسیدن به سرعت C، بدن به یک پرتو بی نهایت و نازک تبدیل می شود حرکت به سرعت نور و متشکل از فوتون هایی که مدت ها را ندارند و توده بی پایان آن به طور کامل به انرژی تبدیل می شود. بنابراین، چنین ماده ای تابش نامیده می شود.
تعریف
کربن - عنصر ششم جدول تناوبی. تعیین - با از لاتین "carboneum". واقع در دوره دوم، گروه IVA. به Nonmetallam اشاره دارد. شارژ هسته 6 است.
کربن در طبیعت در دولت آزاد و به شکل اتصالات متعدد است. کربن رایگان در قالب الماس و گرافیت یافت می شود. علاوه بر ذغال سنگ فسیلی، تجمع زیادی از روغن در عمق زمین قرار دارد. در پوسته زمین مقدار زیادی از نمک های اسید کربنیک، به خصوص کربنات کلسیم وجود دارد. همیشه دی اکسید کربن در هوا وجود دارد. در نهایت، ارگانیسم های گیاهی و حیوانی شامل مواد تشکیل دهنده، در شکل گیری آن کربن بخشی می شود. بنابراین، این عنصر یکی از رایج در زمین است، هرچند محتوای کلی آن در پوسته زمین تنها حدود 0.1٪ (جرم) است.
وزن اتمی و مولکولی کربن
وزن مولکولی نسبی ماده (MR) یک عدد است که نشان می دهد چند بار توده این مولکول بیشتر از 12/12 توده اتم کربن است و توده نسبی اتمی عنصر (AR) چند بار آن است میانگین وزن اتم های شیمیایی شیمیایی بیش از 1/12 توده اتم کربن است.
از آنجایی که در حالت آزاد کربن موجود است، به شکل مولکول های تک تک ملت C، مقادیر توده های اتمی و مولکولی آن هماهنگ است. آنها برابر با 12.0064 هستند.
اصلاحات کربن آلوتروپیک و آلوتروپیک
در حالت آزاد کربن موجود در شکل یک کریستال الماس در سیستم مکعب و شش ضلعی (LONSDELIT) و گرافیت متعلق به سیستم شش ضلعی (شکل 1) وجود دارد. چنین فرم های کربن مانند زغال چوب، کک یا سه گانه یک ساختار غیر ارادی دارد. همچنین تغییرات آلوتروپیک به دست آمده از طریق روش های مصنوعی وجود دارد - این کربن و پلی کولر است - انواع کربن، ساخته شده از پلیمرهای زنجیره ای خطی مانند -C \u003d C- یا \u003d C \u003d C \u003d.
شکل. 1. اصلاحات کربن آلوتروپیک.
تغییرات کربن آلوتروپیک نیز شناخته شده است، داشتن نام های زیر: گرافن، فولرین، نانولوله ها، نانوفیبر، Astlanela، مرز شیشه ای، نانولوله های عظیم؛ کربن آمورف، نانی کربن و نانو کربن.
ایزوتوپهای کربن
در طبیعت، کربن در قالب دو ایزوتوپ پایدار 12 درجه سانتیگراد (98.98٪) و 13 C (1.07٪) وجود دارد. تعداد توده های آنها به ترتیب 12 و 13 است. هسته ایزوتوپ کربن اتم 12 درجه شامل شش پروتون و شش نوترون است و ایزوتوپ 13 C همان تعداد پروتون ها و پنج نوترون است.
یک ایزوتوپ کربن مصنوعی (رادیواکتیو) کربن 14 SS نیمه عمر برای 5730 سال وجود دارد.
یونهای کربن
در سطح انرژی خارجی اتم کربن چهار الکترون وجود دارد که والنس هستند:
1S 2 2S 2 2P 2.
به عنوان یک نتیجه از تعامل شیمیایی، کربن می تواند الکترونهای ولنس خود را از دست بدهد، I.E. به عنوان اهدا کننده خود، و تبدیل به یون های مثبت شارژ و یا گرفتن الکترونهای اتم دیگر، I.E. به عنوان پذیرش آنها، و تبدیل به یون های شارژ منفی:
C 0 -2E → C 2+؛
C 0 -4E → C 4+؛
با 0 + 4E → با 4-.
مولکول و اتم کربن
در حالت آزاد کربن موجود در قالب مولکول های تک نام C وجود دارد. ما برخی از خواص مشخصه های اتم و مولکول کربن را ارائه می دهیم:
آلیاژهای کربن
معروف ترین آلیاژهای کربن در سراسر جهان فولاد و چدن است. فولاد آلومینیوم آهن با کربن، محتوای کربن است که در آن 2٪ تجاوز نمی کند. در چدن چدن (همچنین آلیاژ آهن با کربن) محتوای کربن بالاتر است - از 2 تا 4٪.
نمونه هایی از حل مشکلات
مثال 1
| وظیفه | چه میزان اکسید کربن (IV) در طول شلیک 500 گرم سنگ آهک حاوی 0.1 کسر توده ای از ناخالصی ها برجسته می شود. |
| تصمیم | ما معادله واکنش سنگ آهک سنگ آهک را بنویسیم: CACO 3 \u003d COO + CO 2 -. ما بسیاری از سنگ آهک خالص را پیدا می کنیم. برای انجام این کار، ابتدا کسری توده ای خود را بدون ناخالصی تعریف می کنیم: w CLEASE (CACO 3) \u003d 1 - W ضعف \u003d 1 - 0.1 \u003d 0.9. متر روشن (CACO 3) \u003d M (CACO 3) × W CLEASE (CACO 3)؛ متر روشن (CACO 3) \u003d 500 × 0.9 \u003d 450 مقدار ماده سنگ آهک را محاسبه کنید: n (CACO 3) \u003d M CLEASE (CACO 3) / M (CACO 3)؛ n (caco 3) \u003d 450/100 \u003d 4.5 mol. با توجه به معادله واکنش N (CaCO 3): N (CO 2) \u003d 1: 1، به این معنی است n (caco 3) \u003d n (co 2) \u003d 4.5 mol. سپس حجم اکسید کربن برجسته (IV) برابر با: v (co 2) \u003d n (co 2) × v m؛ v (co 2) \u003d 4.5 × 22.4 \u003d 100.8 لیتر. |
| پاسخ | 100.8 L. |
مثال 2
| وظیفه | چقدر یک راه حل است که حاوی 0.05 کسری توده ای یا 5٪ کلرید، برای خنثی سازی 11.2 گرم کربنات کلسیم است؟ |
| تصمیم | ما معادله واکنش خنثی سازی کربنات کلسیم را با کلرید بنویسیم: CACO 3 + 2HCL \u003d CACL 2 + H 2 O + CO 2 -. مقدار مواد کربنات کلسیم را پیدا کنید: متر (CaCO 3) \u003d A r (ca) + a r (c) + 3 × a r (o)؛ متر (CaCO 3) \u003d 40 + 12 + 3 × 16 \u003d 52 + 48 \u003d 100 g / mol. n (CACO 3) \u003d M (CACO 3) / M (CACO 3)؛ n (caco 3) \u003d 11.2 / 100 \u003d 0،112 مول. با توجه به معادله واکنش N (CaCO 3): N (HCL) \u003d 1: 2، به این معنی است n (hcl) \u003d 2 × n (caco 3) \u003d 2 × 0،224 مول. ما جرم ماده کلر تولید شده در محلول را تعریف می کنیم: m (hcl) \u003d a r (h) + a r (cl) \u003d 1 + 35.5 \u003d 36.5 g / mol. m (hcl) \u003d n (hcl) × m (hcl) \u003d 0.224 × 36،5 \u003d 8،176 توده محلول کلروودور را محاسبه کنید: راه حل M (HCl) \u003d M (HCl) × 100 / W (HCL)؛ راه حل M (HCL) \u003d 8.176 × 100/5 \u003d 163.52 |
| پاسخ | 163.52 |
مشخصات فیزیکی: کربن بسیاری از تغییرات آلوتروپیک را تشکیل می دهد: الماس - یکی از جامدات، گرافیت، ذغال سنگ، دوده.
اتم کربن دارای 6 الکترون است: 1s 2 2s 2 2p 2 . دو الکترون اخیر در جداگانه P-Orbitals قرار دارند و از بین می روند. در اصل، این زن و شوهر می تواند یک مداری را اشغال کند، اما در این مورد، انفجار interelectronic افزایش می یابد. به همین دلیل، یکی از آنها 2P X را اشغال می کند، و دیگری یا 2R Y , هر دو 2R Z-ORBITALI.
تفاوت در انرژی S- و P-pylons از لایه بیرونی کوچک است، بنابراین اتم بسیار آسان است برای رفتن به یک حالت هیجان انگیز، که در آن یکی از دو الکترون با 2S Orbitals به رایگان می رود 2P. حالت واضح رخ می دهد، داشتن یک پیکربندی 1S 2 2S 1 2P X 1 2P Y 1 2P Z 1 . این وضعیت اتم کربن است که مشخصه شبکه الماس است - تطبیق فضایی تتراپرال از اوربیتال های هیبریدی، طول و انرژی اوراق قرضه.
این پدیده شناخته شده است، نامیده می شود sP 3-hybridization، و توابع در حال ظهور - SP 3-hybrid . آموزش چهار SP 3 -Cound فراهم می کند اتم کربن یک حالت پایدار تر از سه p-r- و یک ارتباط S-S. علاوه بر SP 3-hybridization، SP 2 و SP-hybridization نیز در اتم کربن مشاهده می شود. . در مورد اول، اعمال متقابل وجود دارد s- و دو p-orbitals. سه معادل SP 2 - اوربیتال هیبریدی های هیبریدی واقع در همان هواپیما با زاویه 120 درجه تشکیل شده است. سومین اوربیتال P بدون تغییر است و به عمود بر هواپیما فرستاده می شود sP 2

در SP-hybridization، اوربیتال های S و P اعمال می شود. بین دو مدار هیبریدی معادل تشکیل شده، یک زاویه 180 درجه رخ می دهد، با دو p-orbitals در هر اتم بدون تغییر باقی می ماند.

کربن Allotrorkia. الماس و گرافیت
در کریستال گرافیت، اتم های کربن در هواپیما های موازی قرار دارند و تاپس های شش ضلعی راست را مصرف می کنند. هر یک از اتم های کربن با سه اتصالات ترکیبی SP 2-Hybrid همراه است. بین هواپیماهای موازی، اتصال به هزینه نیروهای ون در والاس انجام می شود. P-orbitals رایگان هر یک از اتم ها عمود بر هواپیماهای اوراق قرضه کوانتومی کار می کنند. همپوشانی آنها، π- پیوند اضافی بین اتم های کربن را توضیح می دهد. بنابراین، از یک کشور ولنس که در آن اتم های کربن در ماده هستند، خواص این ماده بستگی دارد.
خواص شیمیایی کربن
مشخصه های مشخصه اکسیداسیون: +4، +2.
در دمای پایین، کربن بی اثر است، اما هنگامی که گرم می شود، فعالیت آن افزایش می یابد.
کربن به عنوان عامل کاهش دهنده:
- با اکسیژن
C 0 + O 2 - T ° \u003d CO 2 دی اکسید کربن
با کمبود اکسیژن - احتراق ناقص:
2C 0 + O 2 - T ° \u003d 2C +2 O گاز فرفری
- با فلوئور
C + 2F 2 \u003d CF 4
- کشتی آب
C 0 + H 2 O - 1200 ° \u003d C +2 O + H 2 گاز آب
- با اکسید های فلزی. بنابراین، فلز از سنگ معدن پرداخت می شود.
C 0 + 2CUO - T ° \u003d 2CU + C +4 O 2
- با اسیدها - عوامل اکسید کننده:
C 0 + 2H 2 SO 4 (CONG.) \u003d C +4 O 2 + 2SO 2 + 2H 2 O
C 0 + 4NO 3 (CONG.) \u003d C +4 O 2 + 4NO 2 + 2H 2 O
- با خاکستری یک کربن سروو را تشکیل می دهد:
C + 2S 2 \u003d CS 2.
کربن مانند عامل اکسید کننده:
- با برخی از فلزات، کاربید را تشکیل می دهند
4AL + 3C 0 \u003d AL 4 C 3
CA + 2C 0 \u003d CAC 2 -4
- با هیدروژن - متان (و همچنین مقدار زیادی از ترکیبات آلی)
C 0 + 2H 2 \u003d CH 4
- با سیلیکون، فرم carbarund (در 2000 درجه سانتیگراد در کوره الکتریکی):
پیدا کردن کربن در طبیعت
کربن COBREL در قالب الماس و گرافیت یافت می شود. در قالب ترکیبات، کربن به عنوان بخشی از مواد معدنی واقع شده است: گچ، سنگ مرمر، سنگ آهک - Saco 3، دولومیت - MGCO 3 * CACO 3؛ بی کربنات - MG (HCO 3) 2 و CA (HCO 3) 2، CO 2 بخشی از هوا است؛ کربن جزء اصلی ترکیبات آلی طبیعی است - گاز، روغن، ذغال سنگ، ذغال سنگ، بخشی از مواد آلی، پروتئین ها، چربی ها، کربوهیدرات ها، اسیدهای آمینه است که بخشی از موجودات زنده هستند.

ترکیبات کربن معدنی
نه 4+ یون، و نه با 4- - نه تحت هیچ فرآیندهای شیمیایی متعارف: در ترکیبات کربن، اوراق قرضه کوانتومی از قطب های مختلف وجود دارد.
اکسید کربن (II)بنابراین
مونوکسید کربن؛ بی رنگ، بی بو، زنده در آب، محلول در حلال های آلی، سمی، T ° کیک \u003d -192 درجه سانتی گراد؛ t pl \u003d -205 درجه سانتیگراد
به دست آوردن
1) در صنعت (در ژنراتور گاز):
C + O 2 \u003d CO 2
2) در آزمایشگاه - تجزیه حرارتی اسید فرمیک یا اگزالیک در حضور H 2 SO 4 (CONG):
hcooh \u003d h 2 o + co
H 2 C 2 O 4 \u003d CO + CO 2 + H 2 O
خواص شیمیایی
تحت شرایط عادی CO INERT؛ هنگامی که گرم می شود - عامل کاهش دهنده؛ اکسید غیر کار
1) با اکسیژن
2C +2 O + O 2 \u003d 2C +4 O 2
2) با اکسید های فلزی
C +2 O + CuO \u003d Cu + C +4 O 2
3) با کلر (در نور)
CO + CL 2 - HN \u003d COCL 2 (PHOSGENE)
4) با ذوب قلیایی (تحت فشار) واکنش نشان می دهد
CO + NAOH \u003d HCOONA (فرمت سدیم)
5) با انتقال فلزات، کربنیل ها را تشکیل می دهند
Ni + 4CO - t ° \u003d ni (co) 4
Fe + 5Co - t ° \u003d fe (co) 5
کربن اکسید (IV) شرکت2
دی اکسید کربن، بی رنگ، بی بو، حلالیت در آب - در 1V H 2 O حل 0.9V CO 2 (در شرایط عادی)؛ هوا سنگین تر؛ t ° PL. \u003d -78.5 درجه سانتیگراد (جامد CO 2 "یخ خشک" نامیده می شود)؛ احتراق را پشتیبانی نمی کند
به دست آوردن
- تجزیه حرارتی نمک های اسید کربنیک (کربنات ها). آهک سنگ آهک:
CACO 3 - T ° \u003d CAO + CO 2
- اثر اسیدهای قوی بر روی کربنات ها و بی کربنات ها:
CACO 3 + 2HCL \u003d CACL 2 + H 2 O + CO 2
Nahco 3 + HCL \u003d NaCl + H 2 O + CO 2
شیمیاییخواصشرکت2
اکسید اسید: با اکسید های پایه و پایه ها واکنش نشان می دهد، تشکیل نمک اسید کربن
na 2 o + co 2 \u003d na 2 co 3
2naoh + co 2 \u003d na 2 co 3 + h 2 o
NaOH + CO 2 \u003d Nahco 3
در دمای بالا ممکن است خواص اکسیداتیو را نشان دهد
C +4 O 2 + 2mg - T ° \u003d 2MG +2 O + C 0
واکنش کیفیت
آب لیمو آب:
CA (OH) 2 + CO 2 \u003d CACO 3 ¯ (رسوب سفید) + H 2 O
آن را با انتقال طولانی مدت CO 2 از طریق آب آهک ناپدید می شود، زیرا کربنات کلسیم نامحلول به یک بی کربنات محلول می رود:
CACO 3 + H 2 O + CO 2 \u003d SA (HCO 3) 2
اسید آکواریک و اوsololi
H 2.CO 3 -اسید ضعیف است، تنها در یک محلول آبی وجود دارد:
CO 2 + H 2 O ↔ H 2 CO 3
دو معدن:
H 2 CO 3 ↔ H + + HCO 3 - نمک های اسیدی - بی کربنات، بی کربنات
HCO 3 - ↔ H + + CO 3 نمک های فعلی - کربنات
تمام خواص اسیدها مشخص هستند.
کربنات ها و بی کربنات ها می توانند به یکدیگر متصل شوند:
2NAHCO 3 - T ° \u003d NA 2 CO 3 + H 2 O + CO 2
NA 2 CO 3 + H 2 O + CO 2 \u003d 2NAHCO 3
کربنات های فلزی (به جز فلزات قلیایی) هنگامی که گرم می شود، با تشکیل اکسید decarboxyylized شده است:
CUCO 3 - T ° \u003d CUO + CO 2
واکنش کیفیت - "جوش" تحت عمل اسید شدید:
NA 2 CO 3 + 2HCL \u003d 2NACL + H 2 O + CO 2
CO 3 2- + 2H + \u003d H 2 O + CO 2
کاربید
کاربید کلسیم:
Cao + 3 C \u003d CAC 2 + CO
CAC 2 + 2 H 2 O \u003d CA (OH) 2 + C 2 H 2.
استیلن هنگامی که واکنش های کاربید روی، کادمیوم، لانتانوم و سرییم آزاد می شود، آزاد می شود:
2 Lac 2 + 6 H 2 O \u003d 2LA (OH) 3 + 2 C 2 H 2 + H 2.
2 C و 4 C 3 با آب به شکل متان تجزیه می شوند:
AL 4 C 3 + 12 H 2 O \u003d 4 AL (OH) 3 \u003d 3 CH 4.
این تکنیک از کاربید تیتانیوم TiC، تنگستن W 2 C (آلیاژهای جامد)، SiC سیلیکون (Carborund - به عنوان ساینده و مواد برای بخاری) استفاده می شود.
سیبانی
به دست آمده از گرمایش سودا در آمونیاک و فضای مونوکسید کربن:
NA 2 CO 3 + 2 NH 3 + 3 CO \u003d 2 NACN + 2 H 2 O + H 2 + 2 CO 2
HCN Sinyl اسید یک محصول مهم صنعت شیمیایی است که به طور گسترده ای در سنتز آلی استفاده می شود. تولید جهانی او به 200 هزار تن در سال می رسد. ساختار الکترونیکی آنیون سیانید شبیه به مونوکسید کربن است (II)، چنین ذرات Isoelectronic نامیده می شود:
C. = o: [: c = n:] -
سیانید ها (0.1-0.2٪ محلول آبی) در طول معدن طلا استفاده می شود:
2 Au + 4 KCN + H 2 O + 0.5 O 2 \u003d 2 K + 2 KOH.
هنگامی که جوشکاری راه حل های سیانید با خاکستری یا فیوژن جامدات تشکیل شده است rodanudy:
KCN + S \u003d KSCN.
هنگام حرارت دادن سیانید های فلزات کم مؤثر، دیتان به دست می آید: Hg (CN) 2 \u003d Hg + (CN) 2. راه حل های سیانید اکسید شده به cianatov:
2 KCN + O 2 \u003d 2 KOCN.
اسید Cianaic در دو شکل وجود دارد:
h-n \u003d c \u003d o؛ h-o-c = n:
در سال 1828، Friedrich Völer (1882-1882) از آمونیوم سیانات اوره دریافت کرد: NH 4 OCN \u003d CO (NH 2) 2 هنگامی که تبخیر محلول آبی.
این رویداد معمولا به عنوان پیروزی شیمی مصنوعی در مورد "نظریه ویتالیستی" در نظر گرفته می شود.
یک ایزومر اسید سینیک وجود دارد - اسید سخت شدن
H-O - n \u003d C.
نمک های آن (HG (ONC) 2) در احتراق شوک استفاده می شود.
سنتز اوره (کربامید):
CO 2 + 2 NH 3 \u003d CO (NH 2) 2 + H 2 O. در 130 0 ثانیه و 100 دستگاه خودپرداز.
اوره یک آمید اسید زغال سنگ است، همچنین "آنالوگ نیتروژن" - گانیدین وجود دارد.
کربناتها
ترکیبات بزرگ کربن معدنی - نمک های اسید کربنیک (کربنات). H 2 CO 3 اسید ضعیف است (K 1 \u003d 1.3 · 10 -4؛ K 2 \u003d 5 · 10 -11). پشتیبانی از کربنات بافر تعادل دی اکسید کربن در جو. اقیانوس جهانی دارای ظرفیت بافر عظیم است، زیرا این سیستم باز است. واکنش بافر اصلی تعادل در طول جداسازی اسید آکوستیک است:
H 2 CO 3 ↔ H + + HCO 3 -.
با اسیدیته پایین، جذب اضافی دی اکسید کربن از اتمسفر با تشکیل اسید رخ می دهد:
CO 2 + H 2 O ↔ H 2 CO 3.
با افزایش اسیدیته، انحلال سنگ های کربنات (سینک، رسوبات گچ و سنگ آهک در اقیانوس رخ می دهد)؛ این جبران کاهش یونهای بی کربنات:
H + + CO 3 2- ↔ HCO 3 -
CACO 3 (تلویزیون) ↔ CA 2+ + CO 3 2-
کربنات جامد به هیدروکربن های محلول منتقل می شود. این فرایند انحلال شیمیایی دی اکسید کربن بیش از حد به "اثر گلخانه ای" - گرمایش جهانی به علت جذب با تابش حرارتی دی اکسید کربن زمین است. تقریبا یک سوم تولید جهانی سودا (سدیم کربنات Na 2 CO 3) در تولید شیشه ای استفاده می شود.
کربن، C، عنصر شیمیایی IV از گروه سیستم دوره ای، وزن اتمی 12.00، شماره توالی 6. تا همین اواخر، کربن در نظر گرفته شده است که دارای ایزوتوپ نیست؛ فقط اخیرا با کمک روش های بسیار حساس برای شناسایی وجود ایزوتوپ از 13 مدیریت شده است. کربن یکی از مهمترین عناصر شیوع آن است، با توجه به ارزش بیولوژیکی (به عنوان یک سازمان)، بر میزان فراوانی استفاده فنی از کربن و ترکیبات آن (به عنوان مواد خام و به عنوان یک ماده خام) یکی از مهمترین عناصر در شیوع آن است منبع انرژی برای نیازهای صنعتی و خانگی) و در نهایت نقش در توسعه علوم شیمیایی نقش دارد. کربن در دولت آزاد، پدیده ای از آلوتروپیک را تشخیص می دهد، که بیش از یک و نیم قرن را شناخته است، اما هنوز به طور کامل به عنوان مشکل شدید برای به دست آوردن کربن در یک فرم خالص شیمیایی شناخته نشده است، و به این دلیل که اکثر ثابت های آلوتروپیک تغییرات کربن تا حد زیادی بسته به ویژگی های مورفولوژیکی ساختار آنها ناشی از روش و شرایط رسید متفاوت است.
کربن دو فرم بلوری - الماس و گرافیت را تشکیل می دهد و علاوه بر این، در حالت آمورف به شکل T.N. زغال سنگ آمورف. فردیت دوم به عنوان یک نتیجه از مطالعات اخیر به چالش کشیده شد: زغال سنگ با گرافیت شناسایی شد، با توجه به همان گونه های مورفولوژیکی یک فرم - "کربن آهنی"، و تفاوت خواص آنها توسط ساختار فیزیکی توضیح داده شد درجه پراکندگی ماده. با این حال، به تازگی، حقایق به دست آمده به دست آمده از وجود زغال سنگ به عنوان یک فرم خاص آلوتروپیک (نگاه کنید به زیر).
منابع طبیعی و سهام کربن. با توجه به شیوع طبیعت، کربن عناصر محل 10 را می گیرد، 0.013٪ از جو، 0.0025٪ از هیدروسفر و حدود 0.35٪ از کل توده پوسته زمین را تشکیل می دهد. بیشتر کربن در قالب ترکیبات اکسیژن است: در هوا اتمسفر حاوی ~ 800 میلیارد تن کربن به شکل دی اکسید CO 2؛ در اقیانوس های آب و دریاها - تا 50،000 میلیارد تن کربن به شکل CO 2، یونی اسید آکواریوم و بی کربنات؛ در سنگ ها - کربنات های نامحلول (کلسیم، منیزیم و سایر فلزات) و سهم یک Camia 3 حساب برای ~ 160 × 10 میلیارد تن کربن. با این حال، این ذخایر عظیم، ارزش انرژی را نشان نمی دهد؛ بسیار ارزشمند تر مواد کربن قابل احتراق - ذغال سنگ فسیلی، ذغال سنگ نارس، سپس روغن، گاز هیدروکربن و سایر قیر طبیعی است. سهام این مواد در پوسته زمین نیز بسیار مهم است: کل توده کربن در زغال سنگ فسیلی به حدود 6000 میلیارد تن می رسد، در روغن ~ 10 میلیارد تن و غیره در حالت آزاد کربن کاملا نادر است (الماس و بخش از ماده اعطا شده) زغال سنگ فسیلی تقریبا یا در همه شامل کربن آزاد نیست: آنها از CH تشکیل شده است. آر از وزن مولکولی بالا (پلیسیکلریک) و ترکیبات کربن بسیار پایدار با عناصر دیگر (H، O، N، S) هنوز بسیار کمی مطالعه شده اند. ترکیبات کربن حیات وحش (زیست محیطی گلوب)، سنتز شده در سلول های گیاهی و حیوانی، در تنوع شدید خواص و کمیت ترکیب متفاوت است؛ شایع ترین مواد در دنیای گیاهی - فیبر و لیگنین - نقش و منابع انرژی را بازی می کنند.
کربن حفظ پایداری توزیع در طبیعت به علت چرخه مداوم، چرخه ای که از سنتز مواد آلی پیچیده در سلول های گیاهی و حیوانی تشکیل شده است و از تجزیه معکوس این مواد در طی پوسیدگی اکسیداتیو (سوزاندن، پوسیدگی، تنفس ) منجر به تشکیل CO 2، که دوباره از گیاهان برای سنتز استفاده می شود. نمودار عمومی این چرخه m. ب ارائه شده در فرم زیر:

گرفتن کربن. ترکیبات کربن منشاء گیاهی و حیوانی ناپایدار در دماهای بالا و نه کمتر از 150-400 درجه سانتیگراد بدون دسترسی به هوا، تجزیه، برجسته کردن آب و ترکیبات کربن فرار و ترک باقی مانده غیر انتفاعی جامد غنی از کربن و معمولا نامیده می شود زغال سنگ این فرآیند پیرولیتیک، شارژ یا تقطیر خشک نامیده می شود و به طور گسترده ای در تکنیک استفاده می شود. Pyrolysis با درجه حرارت بالا ذغال سنگ فسیلی، روغن و ذغال سنگ نارگیل (در دمای 450-1150 درجه سانتیگراد) منجر به جداسازی کربن در یک فرم گرافیکی می شود (کک، زغال سنگ Retort). بالاتر از دمای انعقادی مواد منبع، این واقعیت است که زغال سنگ یا کک به ترکیب کربن آزاد نزدیک تر است و با توجه به خواص به گرافیت.
زغال سنگ آمورف در دمای زیر 800 درجه سانتیگراد تشکیل شده است، نه m. ب ما به عنوان کربن آزاد در نظر می گیریم، زیرا حاوی مقادیر قابل توجهی از عناصر دیگر شیمیایی مرتبط است، CH. آر هیدروژن و اکسیژن. از محصولات فنی به گوشه های آمورف نزدیک به خواص کربن فعال و دوده است. خالص ترین کربن m. ب آن را با شارژ شکر خالص یا پرفین، پردازش ویژه ای از بخار گاز، و غیره به دست آمد. گرافیت مصنوعی به دست آمده از طریق ابزار الکتریکی به دست آمده، با توجه به ترکیب تقریبا خالص کربن. گرافیت طبیعی همیشه با ناخالصی های معدنی آلوده است و علاوه بر این، حاوی تعدادی از هیدروژن مرتبط (H) و اکسیژن (O) است. در یک حالت نسبتا خالص، آن را m. ب این تنها پس از یک سری از درمان های ویژه به دست آمد: غنی سازی مکانیکی، فلاشینگ، پردازش اکسیداسیون، پردازش اکسید کننده و کالسیکسیون در دمای بالا تا زمانی که کاملا حذف مواد فرار. تکنولوژی کربن هرگز با کربن کاملا خالص برخورد نمی کند؛ این نه تنها به مواد خام طبیعی کربن، بلکه همچنین به محصولات غنی سازی، پالایش و تجزیه حرارتی آن (Pyrolysis) اعمال می شود. در زیر محتوای کربن در برخی از مواد کربن (در٪):

خواص فیزیکی کربن. کربن رایگان تقریبا به طور کامل اختصاص داده شده، غیر اوقات فراغت و در دمای معمولی نامحلول در هر یک از حلال های شناخته شده است. این تنها در برخی از فلزات مذاب حل می شود، به خصوص در دمای نزدیک به نقطه جوش دوم: در غدد (تا 5٪)، نقره (تا 6٪) | روتنیم (تا 4 درصد)، کبالت، نیکل، طلا و پلاتین. در غیاب اکسیژن، کربن مواد مقاوم در برابر حرارت است؛ حالت مایع برای کربن خالص ناشناخته است و تحول آن به بخار تنها در دمای بالاتر از 3000 درجه سانتیگراد آغاز می شود. بنابراین، تعیین خواص کربن به طور انحصاری برای یک حالت جامد جامد انجام شد. از تغییرات کربن، ALMAZ دارای خواص فیزیکی ثابت است؛ خواص گرافیت در نمونه های مختلف (حتی تمیزترین) به طور قابل توجهی متفاوت است؛ خواص زغال سنگ آمورف حتی بیشتر نیست. مهمترین ثابت های فیزیکی تغییرات کربن مختلف به جدول نقشه برداری می شود.

الماس یک دی الکتریک معمولی است، در حالی که گرافیت و ذغال سنگ دارای هدایت الکتریکی فلز هستند. در ارزش مطلق، هدایت آنها تغییر در محدودیت های بسیار گسترده، اما برای زغال سنگ آن همیشه کمتر از گرافیت است؛ گرافیست ها به هدایت فلزات واقعی نزدیک می شوند. ظرفیت گرما تمام تغییرات کربن در دمای هوا\u003e 1000 درجه سانتیگراد تمایل به دائما ارزش 0.47 دارد. در دمای پایین تر از -180 درجه سانتیگراد، ظرفیت حرارتی الماس به طور کلی و در دمای -27 درجه سانتیگراد، تقریبا برابر با صفر است.
خواص شیمیایی کربن. هنگامی که گرما بیش از 1000 درجه سانتیگراد گرم می شود، هر دو الماس و زغال سنگ به تدریج به گرافیت تبدیل می شوند، بنابراین باید به عنوان پایدار ترین (تحت شرایط درجه حرارت بالا) شکل کربن مونوتروپیک در نظر گرفته شود. تبدیل زغال سنگ آمورف به گرافیت به طور ظاهرا حدود 800 درجه سانتیگراد آغاز می شود و در دمای 1100 درجه سانتیگراد به پایان می رسد (در این نقطه آخر، زغال سنگ فعالیت جذب آن و توانایی دوباره فعال سازی را از دست می دهد و هدایت الکتریکی آن به شدت افزایش می یابد و در آینده تقریبا ثابت می شود) . برای کربن آزاد، inertia در دمای معمولی و فعالیت قابل توجهی مشخص می شود - در بالا. فعال ترین مواد شیمیایی زغال سنگ آمورف است، در حالی که الماس دارای بالاترین مقاومت است. به عنوان مثال، فلوئور با ذغال سنگ در دمای 15 درجه سانتیگراد واکنش نشان می دهد، با گرافیت تنها در دمای 500 درجه سانتیگراد و با الماس در دمای 700 درجه سانتیگراد. هنگامی که در هوا گرم می شود، زغال سنگ متخلخل شروع به اکسید زیر 100 درجه سانتیگراد، گرافیت حدود 650 درجه سانتیگراد، الماس بیش از 800 درجه سانتیگراد. در دمای 300 درجه سانتیگراد و بالاتر، زغال سنگ خاکستری را به CS 2 سروو کربن ترکیب می کند. در دمای بالای 1800 درجه سانتیگراد، کربن (ذغال سنگ) شروع به ارتباط با نیتروژن، تشکیل (در مقادیر جزئی) Dicyan C 2 N 2 آغاز می شود. تعامل کربن با هیدروژن در دمای 1200 درجه سانتیگراد آغاز می شود و تنها متان CH 4 در محدوده دما 1200-1500 درجه سانتیگراد تشکیل شده است؛ بیش از 1500 درجه سانتیگراد - مخلوطی از متان، اتیلن (C 2 H 4) و استیلن (C 2 H 2)؛ در دمای حدود 3000 درجه سانتیگراد، تقریبا به طور انحصاری استیلن تبدیل می شود. در دمای قوس الکتریکی، کربن به اتصال مستقیم با فلزات، سیلیکون و بور می آید، کاربید مناسب را تشکیل می دهد. مسیرهای مستقیم یا غیر مستقیم m. ب ترکیبات کربن با تمام عناصر شناخته شده، به جز برای گازهای صفر، به دست آمد. کربن یک عنصر غیر فلزی است که برخی از نشانه های آمفوتوری را نشان می دهد. اتم کربن دارای قطر 1.50 ᾰ (1/1 \u003d 10 -8 سانتی متر) است و شامل در حوزه بیرونی 4 الکترون valence است که به راحتی به دست می آید 8؛ بنابراین، ارزش عادی کربن هر دو اکسیژن و هیدروژن برابر با چهار است. در اکثریت قریب به اتفاق ترکیبات آن Tetravalenten کربن؛ فقط در تعداد کمی، ترکیبات شناخته شده از کربن دو طرفه (مونوکسید کربن و استال، ایزونیتریل، اسیدهای سرخ شده و نمک آن) شناخته شده است و سه گانه (به اصطلاح "رادیکال آزاد").
با اکسیژن، کربن شکل دو اکسید نرمال: کربن دی اکسید کربن CO 2 اسید و کربن کربن CO. علاوه بر این، یک عدد وجود دارد کربن هماهنگحاوی بیش از 1 اتم بدون اهمیت فنی؛ از این، ترکیب شناخته شده ترین ترکیب ترکیب C 3 O 2 (گاز با نقطه جوش + 7 درجه سانتیگراد و نقطه ذوب -111 درجه سانتیگراد). اولین محصول احتراق کربن و ترکیبات آن CO 2 تشکیل شده توسط معادله:
C + O 2 \u003d CO 2 +97600 CAL.
آموزش و پرورش با احتراق ناقص سوخت، نتیجه فرآیند توانبخشی ثانویه است؛ عامل کاهش دهنده در این مورد به عنوان خود کربن عمل می کند که در دمای بالای 450 درجه سانتیگراد با معادله CO 2 واکنش نشان می دهد:
CO 2 + C \u003d 2CO -38800 CAL؛
این واکنش برگشت پذیر است بالاتر از 950 درجه سانتیگراد، تبدیل CO 2 به C تقریبا کامل انجام می شود، که در کوره های تولید شده گاز انجام می شود. ظرفیت کاهش انرژی کربن در دمای بالا نیز در آماده سازی گاز آب (H 2 O + C \u003d CO + H 2 -28380 CAL) و در فرآیندهای متالورژیکی استفاده می شود - برای به دست آوردن فلز آزاد از اکسید آن. به عمل برخی از اکسیدان ها، اشکال آلتروپیک کربن آلتو متفاوت است: به عنوان مثال، مخلوطی از KCIO 3 + HNO 3 بر روی یک الماس به طور کامل عمل نمی کند، زغال سنگ آمورف توسط آن به طور کامل در CO 2 اکسید شده است، گرافیت ترکیبات را می دهد سری های معطر - اسیدهای گرافیتی با فرمول تجربی (از 2) X و بیشتر اسید ملتک C 6 (پسر) 6. ترکیبات کربن با هیدروژن - هیدروکربن ها - بسیار زیاد؛ آنها ژنتیکی بیشتر ترکیبات آلی باقی مانده را تولید می کنند، که در آن علاوه بر کربن، اغلب در N، O، N، S و Halides گنجانده شده است.
انواع استثنایی از ترکیبات ارگانیک، که به دلیل برخی از ویژگی های کربن به عنوان یک عنصر به 2 میلیون نفر شناخته می شود. 1) کربن با قدرت پیوند شیمیایی با بسیاری از عناصر دیگر از هر دو شخصیت فلز و غیر فلزی مشخص می شود، به طوری که آن را به اندازه کافی ترکیبات پایدار و با دیگران تشکیل می دهد. هنگام وارد شدن به ترکیب با عناصر دیگر، کربن بسیار کم است به شکل گیری یون ها. اکثر ترکیبات ارگانیک - نوع هومیوپولار و در شرایط عادی آن را از بین نمی برد؛ شکاف اتصالات داخل مولکولی در آنها اغلب نیاز به هزینه های مقدار قابل توجهی از انرژی دارد. هنگامی که بر قدرت پیوندها قضاوت شد، باید مشخص شود؛ الف) قدرت ارتباط مطلق، قابل اندازه گیری توسط ترمو شیمیایی، و ب) توانایی ارتباطات به شکستن تحت عمل واکنش های مختلف؛ این دو ویژگی همیشه همزمان نیستند. 2) اتم های کربن با سهولت استثنایی همراه با یکدیگر (غیر قطبی)، تشکیل زنجیره کربن، باز یا بسته است. طول چنین زنجیرها ظاهرا به هیچ محدودیتی برخورد نمی شود؛ بنابراین، مولکول های پایدار با زنجیره های باز 64 اتم کربن شناخته شده اند. طول عمر و عوارض مدارهای باز بر قدرت ارتباط ارتباطات آنها بین خود و یا با عناصر دیگر منعکس نمی شود. در میان مدارهای بسته، حلقه های 6 و 5 عضو به راحتی شکل می گیرند، گرچه زنجیرهای حلقه ای حاوی 3 تا 18 اتم کربن شناخته شده اند. توانایی اتم های کربن به اتصال متقابل به خوبی توضیح می دهد خواص ویژه گرافیت و مکانیسم فرآیندهای چاه؛ آن را روشن می کند و این واقعیت است که کربن به شکل مولکول های دیاتومیک C 2 ناشناخته است، که می تواند با مقایسه با دیگر عناصر غیر فلزی نور (در کربن شکل بخار شامل مولکول های تک گاوها باشد). 3) با توجه به ماهیت غیر قطبی اوراق قرضه، بسیاری از ترکیبات کربن دارای inertia شیمیایی نه تنها خارجی (کمبود پاسخ)، بلکه داخلی (سختی بازپرداخت داخل مولکولی). حضور مقاومتی بزرگ "مقاومت منفعل" به شدت پیچیدگی تبدیل خودبخودی فرم های ناپایدار را به پایدار، اغلب کاهش سرعت چنین تحول به صفر کاهش می دهد. نتیجه امکان اجرای تعداد زیادی از اشکال ایزومری است، تقریبا به همان اندازه در دمای معمولی پایدار است.
Allotropy و ساختار کربن اتمی . تجزیه و تحلیل رادیوگرافی قادر به ایجاد ساختار اتمی الماس و گرافیت با قابلیت اطمینان است. همان روش تحقیق، نور را کاهش داد و در مورد وجود سومین اصلاح کربن آلترروپیک، که اساسا موضوعی از آمورفیک یا زغال سنگ زغال سنگ است: اگر ذغال سنگ تحصیلات آمورف باشد، این نیست. ب این با یک گرافیت شناسایی شده و نه با یک الماس، بلکه باید به عنوان یک نوع خاص از کربن به عنوان یک ماده ساده فرد شناخته شود. در الماس، اتم های کربن قرار می گیرند، زیرا هر اتم در مرکز تتراهدرون قرار دارد، بالای آن 4 اتم مجاور است؛ هر یک از دومی به نوبه خود مرکز دیگری از همان تتراهاد است؛ فاصله بین اتم های مجاور برابر با 1.54 ᾰ (لبه ی مکعب ابتدایی شبکه کریستال 3.55 ᾰ است). چنین ساختار فشرده ترین است؛ این مربوط به سختی بالا، تراکم و بی اثر شیمیایی الماس (توزیع یکنواخت نیروهای والنس) است. رابطه متقابل اتم های کربن در شبکه الماس همانند مولکول های اکثر ترکیبات آلی سری چربی (یک مدل کربن تترالید) است. در کریستال های گرافیت، اتم های کربن لایه های متراکم قرار گرفته اند، یکی از دیگر 3.35-3،41 ᾰ؛ جهت این لایه ها با هواپیماهای SPHEEL و هواپیماهای لغزنده در تغییر شکل مکانیکی همخوانی دارد. در هواپیما هر لایه اتم یک شبکه را با سلول های شش ضلعی تشکیل می دهند (شرکت ها)؛ طرف چنین شش ضلعی برابر با 1.42-1.45 ᾰ است. در لایه های مجاور، شش ضلعی زیر دیگری دروغ نمی گویند: تصادف عمودی آنها تنها پس از 2 لایه در سوم تکرار می شود. سه اوراق قرضه هر اتم کربن در همان هواپیما قرار می گیرند، زاویه های 120 درجه را تشکیل می دهند؛ اتصال چهارم به طور متناوب در یک یا طرف دیگر هواپیما به اتم های لایه های همسایه متصل می شود. فاصله بین اتم ها در لایه به شدت ثابت است، فاصله بین لایه های فردی M. B. تغییر یافته توسط تاثیرات خارجی: بنابراین، هنگامی که فشار تحت فشار تا 5000 دستگاه خودپرداز، آن را به 2.9 ᾰ کاهش می یابد، و در طول تورم گرافیت در HNO 3 متمرکز - افزایش به 8 ᾰ. در هواپیما یک لایه، اتم های کربن با هومیوپولار ارتباط دارند (هر دو در زنجیرهای هیدروکربن)، اتصال بین اتم های لایه های مجاور دارای شخصیت فلزی بیشتری هستند؛ این را می توان از این واقعیت دیده می شود که هدایت الکتریکی کریستال های گرافیت در جهت عمود بر لایه ها حدود 100 برابر هدایت در جهت لایه است. T. درباره گرافیت دارای خواص فلزی در یک جهت و خواص غیر فلز است - در دیگری. محل اتم های کربن در هر لایه از مشبک گرافیت کاملا مشابه در مولکول های ترکیبات پیچیده معطر است. چنین پیکربندی به خوبی توضیح می دهد. اصلاح آمورف کربن آهن، ظاهرا، به عنوان یک فرم مستقل (O. Ruff) وجود دارد. برای آن، به احتمال زیاد ساختار سلولی فوم، بدون هیچ گونه صحت؛ دیوارهای این سلول ها توسط لایه های اتم های فعال تشکیل می شوندکربن ضخامت حدود 3 اتم. در عمل، یک ماده فعال زغال سنگ معمولا تحت پوسته اتم های کربن غیر فعال قرار می گیرد، گرافیکی گرافیکی را هدایت می کند و با گنجایش کریستالهای گرافیت بسیار کوچک نفوذ می کند. نقطه خاصی از تبدیل ذغال سنگ → گرافیت احتمالا در دسترس نیست: یک انتقال مداوم بین هر دو اصلاح وجود دارد، که طی آن تصادفی از توده تاج C- اتم های زغال سنگ آمورف به لحیم کاری کریستال کریستال صحیح رخ می دهد. با توجه به موقعیت بی وقفه آن، اتم های کربن در زاویه آمورف با حداکثر وابستگی باقی مانده ظاهر می شود که (با توجه به نمایندگی های لانگمیور بر هویت نیروهای جذب با نیروهای والنس) مربوط به ویژگی های جذب بالا و کاتالیزوری بالا است زغال سنگ اتم های شیشه ای کربن بر روی کلاچ متقابل تمام وابستگی خود را (در الماس) یا بیشتر آن (در گرافیت) صرف می کنند؛ این مربوط به کاهش فعالیت شیمیایی و فعالیت جذب است. جذب بادام تنها بر روی سطح کریستال تک، گرافیت، همان والنس باقی مانده می تواند خود را بر روی هر دو سطح شبکه مسطح (در کرم "بین لایه های اتم ها)، که توسط واقعیت توانایی گرافیت تایید شده است برای فرو رفتن در مایعات (HNO 3) و مکانیسم اکسیداسیون آن به اسید گرافیت.
ارزش فنی کربن. به عنوان b یا m کربن آزاد، که در فرایندهای شغلی و کوکنگ به دست آمده است، استفاده از آن در تکنیک بر اساس هر دو شیمیایی (بی اثر، توانایی ترمیم) و خواص فیزیکی آن (مقاومت به حرارت، هدایت الکتریکی، ظرفیت جذب) است. بنابراین، کک و زغال چوب، علاوه بر استفاده مستقیم از آنها به عنوان یک سوخت آلاینده، برای به دست آوردن قابل احتراق گاز (گازهای ژنراتور) استفاده می شود؛ در متالورژی فلزات سیاه و غیر آهنی - برای بازگرداندن اکسید های فلزی (Fe، Cu، Zn، Ni، SG، Mn، W، Mo، Sn، As، SB، BI)؛ در تکنولوژی شیمیایی - به عنوان یک عامل کاهش دهنده برای تهیه سولفید (Na، CA، VA) از سولفات ها، نمک های کلرید بدون آب (Mg، Al)، از اکسید های فلزی، تولید شیشه ای محلول و فسفر - به عنوان مواد خام برای تولید کاربید کلسیم، کربند و سایر کاربید Seroublerod، و غیره؛ در کسب و کار ساخت و ساز - به عنوان مواد حرارتی حرارتی. زغال سنگ Retort و COKE به عنوان مواد برای الکترودهای کوره های الکتریکی، حمام های الکترولیتیک و عناصر الکتریکی، برای تولید زغال سنگ قوس، ریزش، برس گردآورنده، ذوب های ذوب، و غیره، و همچنین به عنوان نازل در تجهیزات شیمیایی نوع برج. زغال چوب به جز برنامه های فوق، برای به دست آوردن مونوکسید کربن متمرکز، نمک های سیانید، برای سیمان سازی فولاد، به عنوان یک جاذب به عنوان یک کاتالیزور برای برخی از واکنش های مصنوعی به طور گسترده ای مورد استفاده قرار می گیرد، در نهایت در ترکیب پودر دودی و سایر مواد منفجره و ترکیبات آتش سوزی شامل می شود .
تعیین تحلیلی کربن. به طور کیفی، کربن با استفاده از مهار مهار ماده بدون دسترسی به هوا (که به طور مناسب برای همه مواد مناسب نیست) یا اکسیداسیون بسیار قابل اعتماد و جامع تر از آن، به عنوان مثال، با استفاده از کلسیم در مخلوط با اکسید مس و شکل گیری از CO 2 با واکنش های متعارف ثابت شده است. برای تعیین کمی کربن، نمونه ای از ماده تحت فشار در فضای اکسیژن قرار می گیرد؛ CO 2 نتیجه توسط یک محلول قلیایی گرفتار شده و با روش های معمول و یا روش های متداول با روش های معمول تجزیه و تحلیل کمی تعیین می شود. این روش برای تعیین کربن نه تنها در ترکیبات آلی و زغال سنگ فنی، بلکه در فلزات مناسب است.