فسفر و ترکیبات آن
مقدمه
فصل I. فسفر به عنوان یک عنصر و به عنوان یک ماده ساده
1.1 فسفر در طبیعت
1.2. مشخصات فیزیکی
1.3 خواص شیمیایی
1.4. دریافت کردن
1.5 کاربرد
فصل دوم ترکیبات فسفر
2.1 اکسیدها
2.2. اسیدها و نمک های آنها
2.3 فسفین
فصل سوم کودهای فسفاته
نتیجه
لیست کتابشناسی
مقدمه
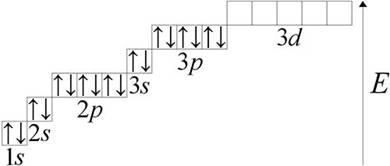
فسفر (فسفر لاتین) P - عنصر شیمیایی گروه V سیستم تناوبی مندلیف شماره اتمی 15 ، جرم اتمی 30.973762 (4). ساختار اتم فسفر را در نظر بگیرید. در سطح انرژی بیرونی اتم فسفر ، پنج الکترون وجود دارد. از لحاظ گرافیکی ، به این شکل است:
1s 2 2s 2 2پ 6 3s 2 3پ 3 3د 0
در سال 1699 ، کیمیاگر هامبورگ X. برند ، در جستجوی "سنگ فیلسوف" ، که ظاهراً قادر به تبدیل فلزات اساسی به طلا است ، هنگام تبخیر ادرار با زغال سنگ و شن و ماسه ، یک ماده مومی سفید را قادر به درخشش جدا کرد.
نام "فسفر" از یونانی آمده است. "Phos" - نور و "phoros" - حامل. در روسیه اصطلاح "فسفر" در سال 1746 توسط M.V. لومونوسوف
ترکیبات اصلی فسفر شامل اکسیدها ، اسیدها و نمک های آنها (فسفات ، فسفات دی هیدروژن ، فسفات هیدروژن ، فسفید ، فسفیت) است.
کودها حاوی بسیاری از مواد حاوی فسفر هستند. به چنین کودهایی کودهای فسفره گفته می شود.
فصلمن فسفر به عنوان یک عنصر و به عنوان یک ماده ساده
1.1 فسفر در طبیعت
فسفر یکی از عناصر رایج است. محتوای کل پوسته زمین در حدود 0.08٪ است. فسفر به دلیل قابلیت اکسیداسیون آسان در طبیعت فقط به صورت ترکیبات یافت می شود. مواد معدنی اصلی فسفر فسفریت و آپاتیت هستند ؛ از دومی ، فلوراپاتیت 3Ca3 (PO 4) 2 CaF2 گسترده ترین است. فسفریت ها در اورال ، منطقه ولگا ، سیبری ، قزاقستان ، استونی و بلاروس بسیار گسترده هستند. بزرگترین ذخایر آپاتیت در شبه جزیره کولا واقع شده است.
فسفر یکی از عناصر اساسی موجودات زنده است. در استخوانها ، عضلات ، بافت مغز و اعصاب وجود دارد. مولکولهای ATP از فسفر ساخته می شوند - اسید آدنوزین تری فسفریک (ATP یک جمع کننده و حامل انرژی است). بدن یک فرد بالغ به طور متوسط \u200b\u200bحدود 4.5 کیلوگرم فسفر دارد که عمدتا در ترکیب با کلسیم است.
فسفر در گیاهان نیز یافت می شود.
فسفر طبیعی تنها از یک ایزوتوپ پایدار تشکیل شده است ، 31 R. امروز شش ایزوتوپ رادیواکتیو فسفر شناخته شده است.
1.2 خواص فیزیکی
فسفر دارای چندین تغییر آلوتروپیک است - فسفر سفید ، قرمز ، سیاه ، قهوه ای ، بنفش و غیره. سه مورد اول بیشترین مطالعه را دارند.
فسفر سفید - بی رنگ ، با ماده بلوری مایل به زرد ، در تاریکی می درخشد. تراکم آن 1.83 گرم در سانتی متر مکعب است. این در آب حل نمی شود ، به خوبی در دی سولفید کربن حل می شود. بوی سیر مشخصی دارد. نقطه ذوب 44 درجه سانتیگراد ، دمای احتراق خودکار 40 درجه سانتیگراد. برای محافظت از فسفر سفید در برابر اکسیداسیون ، در تاریکی زیر آب ذخیره می شود (در نور به فسفر قرمز تبدیل می شود). در سرما ، فسفر سفید شکننده است ، در دمای بالاتر از 15 درجه سانتیگراد نرم می شود و با چاقو بریده می شود.
مولکول ها فسفر سفید دارای یک شبکه کریستالی هستند که در گره های آن مولکولهای P4 به صورت چهار ضلعی وجود دارد.
هر اتم فسفر توسط سه پیوند σ به سه اتم دیگر متصل می شود.
فسفر سفید سمی است و سوختگی های سخت ترمیم می کند.
فسفر قرمز– یک ماده پودری از رنگ قرمز و تیره بدون بو ، در آب و دی سولفید کربن حل نمی شود ، درخشان نمی شود. دمای احتراق 260 درجه سانتیگراد ، تراکم 2.3 گرم در سانتی متر 3. فسفر قرمز مخلوطی از چندین تغییر آلوتروپیک است که در رنگ متفاوت است (از قرمز به بنفش). خصوصیات فسفر قرمز به شرایط تولید آن بستگی دارد. سمی نیست
فسفر سیاهاز نظر ظاهری شبیه به گرافیت ، چرب با لمس ، دارای ویژگی های نیمه رسانا است. تراکم 2.7 گرم در سانتی متر 3.
فسفر قرمز و سیاه دارای شبکه بلوری اتمی است.
1.3 خواص شیمیایی
فسفر غیر فلزی است. در ترکیبات ، معمولاً حالت اکسیداسیون 5+ نشان می دهد ، کمتر - 3 و 3 (فقط در فسفیدها).
واکنش با فسفر سفید آسان تر از فسفر قرمز است.
تعامل با مواد ساده.
1. تعامل با هالوژن ها:
2P + 3Cl 2 \u003d 2PCl 3 (کلرید فسفر (III)) ،
PCl 3 + Cl 2 \u003d PCl 5 (فسفر (V) کلرید).
2. تعامل با نماتال ها:
2P + 3S \u003d P 2 S 3 (فسفر (III) سولفید.
3. تعامل با فلزات:
2P + 3Ca \u003d Ca 3 P 2 (فسفید کلسیم).
4- تعامل با اکسیژن:
4P + 5O 2 \u003d 2P 2 O 5 (فسفر (V) اکسید ، انیدرید فسفریک).
دوم تعامل با مواد پیچیده
3P + 5HNO 3 + 2H 2 O \u003d 3H 3 PO 4 + 5NO.
1.4 به دست آوردن
فسفر از فسفریت خرد شده و آپاتیت بدست می آید ، دومی با زغال سنگ و شن مخلوط می شود و در کوره های 1500 درجه سانتیگراد کلسینه می شود:
2Ca 3 (PO 4) 2 + 10C + 6SiO 2 6CaSiO 3 + P 4 + 10CO.
فسفر به صورت بخار آزاد می شود ، که در گیرنده زیر آب متراکم می شود و فسفر سفید ایجاد می کند.
هنگامی که بدون دسترسی هوا در دمای 300-350 درجه سانتی گراد گرم می شود ، فسفر سفید به قرمز تبدیل می شود.
فسفر سیاه با گرم شدن طولانی مدت فسفر سفید در فشارهای بسیار زیاد (200 درجه سانتیگراد و 1200 مگاپاسکال) بدست می آید.
1.5 برنامه
از فسفر قرمز در ساخت کبریت استفاده می شود (تصویر را ببینید). این بخشی از مخلوطی است که در کنار جعبه کبریت استفاده می شود. جز component اصلی ترکیب سر کبریت نمک KClO 3 Berthollet است. از اصطکاک سر مسابقه در برابر گسترش جعبه ، ذرات فسفر در هوا مشتعل می شوند. در نتیجه واکنش اکسیداسیون فسفر ، گرما آزاد می شود و منجر به تجزیه نمک برتولت می شود.
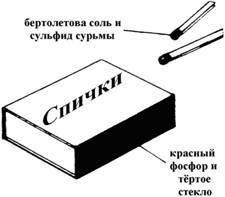
اکسیژن حاصل به احتراق سر کبریت کمک می کند.
از فسفر در متالورژی استفاده می شود. برای بدست آوردن رساناها استفاده می شود و بخشی از برخی از مواد فلزی مانند برنزهای قلع است.
همچنین ، از فسفر در تولید استفاده می شود اسید فسفریک و سموم دفع آفات (dichlorvos ، chlorophos و غیره).
از فسفر سفید برای ایجاد صفحات نمایش دود استفاده می شود ، زیرا هنگام سوختن دود سفید تولید می کند.
فصلدوم... ترکیبات فسفر
2.1 اکسیدها
فسفر چندین اکسید تشکیل می دهد. مهمترین آنها اکسید فسفر (V) P 4 O 10 و اکسید فسفر (III) P 4 O 6 است. اغلب فرمول های آنها به صورت ساده - P 2 O 5 و P 2 O 3 نوشته می شوند. ساختار این اکسیدها آرایش چهار وجهی اتم های فسفر را حفظ می کند.
اکسید فسفر (III) P 4 O 6 توده بلوری مومی است که در 22.5 درجه سانتیگراد ذوب می شود و به مایع بی رنگ تبدیل می شود. سمی
وقتی در آب سرد حل می شود ، اسید فسفر تشکیل می دهد:
P 4 O 6 + 6H 2 O \u003d 4H 3 PO 3 ،
و هنگام واکنش با مواد قلیایی ، نمک های مربوطه (فسفیت ها).
عامل کاهنده قوی. هنگام تعامل با اکسیژن ، آن را به P 4 O 10 اکسید می کنند.
اکسید فسفر (III) با اکسیداسیون فسفر سفید با کمبود اکسیژن بدست می آید.
اکسید فسفر (V) P 4 O 10 یک پودر کریستالی سفید است. دمای تصعید 36 درجه سانتیگراد است. چندین تغییر دارد که یکی از آنها (اصطلاحاً فرار) دارای ترکیب P4 O 10 است. شبکه کریستالی این اصلاحات از مولکولهای P4O10 تشکیل شده است ، که توسط نیروهای ضعیف بین مولکولی به هم پیوسته اند و با گرم شدن به راحتی از هم جدا می شوند. از این رو نوسانات این گونه است. سایر تغییرات پلیمری است. آنها توسط لایه های بی پایان PO 4 tetrahedra تشکیل شده اند.
هنگامی که P 4 O 10 با آب ارتباط برقرار می کند ، اسید فسفریک تشکیل می شود:
P 4 O 10 + 6H 2 O \u003d 4H 3 PO 4.
بودن اکسید اسیدی، Р 4 О 10 با اکسیدهای اساسی و هیدروکسیدها واکنش نشان می دهد.
در طی اکسیداسیون دمای بالا فسفر در اکسیژن اضافی (هوای خشک) تشکیل می شود.
از اکسید فسفر (V) به دلیل خاصیت رطوبتی فوق العاده ای که دارد ، در فناوری آزمایشگاهی و صنعتی به عنوان ماده خشک کننده و کم آب استفاده می شود. از نظر اثر خشک کردن ، از همه مواد دیگر پیشی می گیرد. آب پیوند خوراکی شیمیایی را از اسید پرکلریک بی آب می گیرد تا انیدرید آن تشکیل شود:
4HClO 4 + P 4 O 10 \u003d (HPO 3) 4 + 2Cl 2 O 7.
2.2 اسیدها و نمک های آنها
و) اسید فسفر H 3 PO 3. اسید فسفره بی آب H3 PO 3 بلورهایی با تراکم 65/1 گرم در سانتی متر مکعب تشکیل می دهد که در دمای 74 درجه سانتیگراد ذوب می شوند.
فرمول ساختاری:
هنگامی که H3 PO 3 بی آب گرم می شود ، یک واکنش نامتناسب (خود اکسیداسیون-خود ترمیم) ایجاد می شود:
4H 3 PO 3 \u003d PH 3 + 3H 3 PO 4.
نمکهای اسید فسفر - فسفیت... به عنوان مثال ، K 3 PO 3 (فسفیت پتاسیم) یا Mg 3 (PO 3) 2 (فسفیت منیزیم).
اسید فسفر Н3 РО 3 با حل شدن اکسید فسفر (III) در آب یا هیدرولیز کلرید فسفر (III) РCl3 بدست می آید:
РCl 3 + 3H 2 O \u003d H 3 PO 3 + 3HCl.
ب) اسید فسفریک (اسید orthophosphoric) H 3 PO 4.
اسید فسفریک بی آب یک بلور شفاف سبک است که در دمای اتاق در هوا پخش می شود. نقطه ذوب 42.35 درجه سانتیگراد با آب ، اسید فسفریک محلولهای هر غلظت را تشکیل می دهد.
اسید فسفریک فرمول ساختاری زیر را دارد:
اسید فسفریک با فلزات واقع در محدوده پتانسیل الکترود استاندارد تا هیدروژن ، با اکسیدهای اساسی ، با بازها و نمک های اسیدهای ضعیف واکنش می دهد.
در آزمایشگاه ، اسید فسفر از اکسیداسیون فسفر با اسید نیتریک 30٪ بدست می آید:
3P + 5HNO 3 + 2H 2 O \u003d 3H 3 PO 4 + 5NO.
در صنعت ، اسید فسفریک از دو طریق استخراج و حرارت به دست می آید. در قلب روش استخراجدرمان فسفات طبیعی خرد شده با اسید سولفوریک است:
Ca 3 (PO 4) 2 + 3H 2 SO 4 \u003d 2H 3 PO 4 + 3CaSO 4.
سپس اسید فسفریک با تبخیر فیلتر شده و غلیظ می شود.
روش حرارتیدر کاهش فسفات طبیعی به فسفر آزاد ، و به دنبال آن احتراق به Р4О10 و انحلال دومی در آب وجود دارد. اسید فسفریک تولید شده با این روش با خلوص بالاتر و غلظت بالاتر (تا 80٪ از نظر وزنی) مشخص می شود.
اسید فسفریک برای تولید کودها ، برای تهیه معرف ها ، مواد آلی ، برای ایجاد پوشش های محافظ روی فلزات استفاده می شود. اسید فسفریک خالص برای تهیه داروها ، کنسانتره های خوراک مورد نیاز است.
اسید فسفریک یک اسید قوی نیست. به عنوان یک اسید تریکازیک ، به صورت گام به گام در محلول آبی جدا می شود. تفکیک در مرحله اول آسان تر است.
1. H 3 PO 4 H + + (یون فسفات دی هیدروژن) ؛
2. H + + (یون هیدروژن فسفات) ؛
3. H + + (یون فسفات).
معادله یونی کل برای تفکیک اسید فسفریک:
H 3 PO 4 3H + +.
اسید فسفریک سه سری نمک تشکیل می دهد:
الف) K 3 PO 4 ، Ca 3 (PO 4) 2 - سه جایگزین یا فسفات ؛
ب) K 2 HPO 4 ، CaHPO 4 - فسفاتهای جایگزین شده یا هیدروژن؛
ج) KH 2 PO 4 ، Ca (H 2 PO 4) 2 - فسفاتهای مونو جایگزین یا دی هیدروژن.
فسفاتهای یک جایگزین واکنش اسیدی دارند ، فسفاتهای جایگزین نشده کمی قلیایی و مواد جایگزین شده سه قلیایی هستند.
تمام فسفاتهای فلز قلیایی و آمونیوم محلول در آب هستند. از نمک های کلسیم اسید فسفریک ، فقط کلسیم دی هیدروژن فسفات در آب حل می شود. کلسیم هیدروژن فسفات و کلسیم فسفات محلول در اسیدهای آلی هستند.
هنگامی که گرم می شود ، اسید فسفریک ابتدا آب را از دست می دهد - یک حلال ، سپس دهیدراته شدن اسید فسفریک شروع می شود و اسید دی فسفریک تشکیل می شود:
2H 3 PO 4 \u003d H 4 P 2 O 7 + H 2 O.
قسمت قابل توجهی از اسید فسفریک در دمای حدود 260 درجه سانتیگراد به اسید دی فسفریک تبدیل می شود.
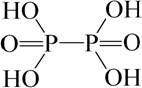
که در) اسید فسفریک (اسید هیپوفسفریک) H 4 P 2 O 6.
 .
.
H 4 P 2 O 6 یک اسید تترابازیک با مقاومت متوسط \u200b\u200bاست. در حین ذخیره سازی ، اسید هیپوفسفریک به تدریج تجزیه می شود. با گرم شدن محلولهای آن به H 3 PO 4 و H 3 PO 3 تبدیل می شود.
با اکسیداسیون آهسته N 3 РО3 در هوا یا اکسیداسیون فسفر سفید در هوای مرطوب تشکیل می شود.
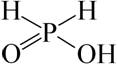
د) اسید هیپوفسفر (اسید هیپوفسفر) H 3 PO 2. این اسید تک پایه ، قوی است. اسید هیپوفسفر با فرمول ساختاری زیر مطابقت دارد:
 .
.
هیپوفسفیت– نمک های اسید هیپوفسفر - معمولاً بسیار محلول در آب است.
Hypophosphites و H 3 PO 2 عوامل کاهنده انرژی هستند (به ویژه در یک محیط اسیدی). ویژگی ارزشمند آنها توانایی کاهش نمکهای محلول برخی از فلزات (Ni ، Cu و غیره) به فلز آزاد است:
2Ni 2+ + + 2H 2 O → Ni 0 + + 6H +.
با تجزیه هیپوفسفیتهای کلسیم یا باریم با اسید سولفوریک ، اسید هیپوفسفر تبدیل می شود:
Ba (H 2 PO 2) 2 + H 2 SO 4 \u003d 2H 3 PO 2 + BaSO 4.
هایفوفسفیت ها با جوشاندن فسفر سفید در سوسپانسیون هیدروکسیدهای کلسیم یا باریم تشکیل می شوند.
2P 4 (سفید) + 3Ba (OH) 2 + 6H 2 O \u003d 2PH 3 + 3Ba (H 2 PO 2) 2.
2.3 فسفین
فسفین PH 3 - ترکیبی از فسفر با هیدروژن - یک گاز بی رنگ با بوی نامطبوع سیر ، به راحتی در آب قابل حل است (با آن واکنش شیمیایی ندارد) ، بسیار سمی است. در هوا ، فسفین خالص و خشک هنگام حرارت دادن بالاتر از 100-140 درجه سانتیگراد مشتعل می شود. اگر فسفین حاوی ناخالصی های دی فسفین P 2 H 4 باشد ، خود به خود در هوا شعله ور می شود.
هنگام تعامل با برخی اسیدهای قوی ، فسفین تشکیل می شود نمکهای فسفونیوم ،به عنوان مثال:
PH 3 + HCl \u003d PH 4 Cl (کلرید فسفونیوم).
ساختار کاتیون فسفونیوم [PH 4] + شبیه ساختار کاتیون آمونیوم است.
آب نمک های فسفونیوم را تجزیه کرده و فسفین و هیدروژن هالید تشکیل می دهد.
فسفین را می توان با تعامل فسفیدها با آب بدست آورد:
Ca 3 P 2 + 6H 2 O \u003d 3Ca (OH) 2 + 2PH 3.
و آخرین چیز هنگامی که فسفر با فلزات برهم کنش دارد ، نمکها تشکیل می شوند - فسفیدها... به عنوان مثال ، Ca 3 P 2 (فسفید کلسیم) ، Mg 3 P 2 (فسفید منیزیم).
فصلIII کودهای فسفاته
ترکیبات فسفر ، و همچنین نیتروژن ، به طور مداوم در طبیعت متحول می شوند - چرخه فسفر در طبیعت رخ می دهد. گیاهان فسفات را از خاک استخراج کرده و به فسفر حاوی پیچیده تبدیل می کنند مواد آلی... این مواد با غذای گیاهی وارد بدن حیوانات می شوند - تشکیل مواد پروتئینی بافت های عصبی و عضلانی ، فسفات کلسیم در استخوان ها و غیره. پس از مرگ حیوانات و گیاهان ، ترکیبات حاوی فسفر تحت اثر میکروارگانیسم ها تجزیه می شوند. در نتیجه ، فسفات ها تشکیل می شوند. بنابراین ، چرخه کامل می شود ، که توسط طرح بیان می شود:
P (موجودات زنده) P (خاک).
با حذف ترکیبات فسفر از محصولات کشاورزی ، این چرخه مختل می شود. کمبود فسفر در خاک عملا به طور طبیعی دوباره پر نمی شود. بنابراین لازم است از کودهای فسفره استفاده شود.
همانطور که می دانید، کودهای معدنی ساده و پیچیده هستند. کودهای ساده شامل کودهای حاوی یک ماده مغذی هستند. کودهای پیچیده حاوی چندین ماده مغذی است.
کودهای فسفاته چگونه در صنعت به دست می آیند؟ فسفات طبیعی در آب حل نمی شود و در محلول های خاک محلول کم است و توسط گیاهان جذب کمی می شود. فرآوری فسفاتهای طبیعی به ترکیبات محلول در آب وظیفه صنایع شیمیایی است. محتوای عنصر غذایی فسفر در کود توسط محتوای اکسید فسفر (V) P 2 O 5 تخمین زده می شود.
جز component اصلی کودهای فسفره کلسیم دی هیدرو یا هیدروژن فسفات است. فسفر در بسیاری از ترکیبات آلی گیاهان یافت می شود. تغذیه فسفر رشد و نمو گیاه را تنظیم می کند. رایج ترین کودهای فسفاته عبارتند از:
1. آرد فسفریت- پودر سفید خوب. حاوی 18-26٪ Р 2 О 5 است.
این ماده با آسیاب کردن فسفریت های Ca 3 (PO 4) 2 بدست می آید.
آرد فسفریت را فقط می توان روی خاکهای podzolic و ذغال سنگ نارس حاوی اسیدهای آلی جذب کرد.
2. سوپرفسفات ساده- پودر دانه ریز خاکستری. حاوی 20٪ Р 2 О 5.
با تعامل فسفات طبیعی با اسید سولفوریک بدست می آید:
Ca 3 (PO 4) 2 + 2H 2 SO 4 \u003d Ca (H 2 PO 4) 2 + 2CaSO 4.
سوپرفسفات
در این حالت مخلوطی از نمک های Ca (H 2 PO 4) 2 و CaSO 4 بدست می آید که به خوبی توسط گیاهان در هر خاکی جذب می شود.
3. سوپرفسفات دوتایی(رنگ و ظاهری شبیه سوپرفسفات ساده).
این ماده با تأثیر بر فسفات اسید فسفریک طبیعی بدست می آید:
Ca 3 (PO 4) 2 + 4H 3 PO 4 \u003d 3Ca (H 2 PO 4) 2.
در مقایسه با سوپرفسفات ساده ، حاوی CaSO4 نیست و کود بسیار غلیظ تری است (حاوی 50٪ P 2 O 5 است).
4. بارش باران- حاوی 35-40٪ Р 2 О 5.
این ماده با خنثی سازی اسید فسفریک با محلول هیدروکسید کلسیم بدست می آید:
H 3 PO 4 + Ca (OH) 2 \u003d CaHPO 4 2H 2 O.
در خاکهای اسیدی استفاده می شود.
5. آرد استخوان... این ماده با پردازش استخوان های حیوانات اهلی بدست می آید ، حاوی Ca3 (PO 4) 2 است.
6. آموفوس- کود پیچیده حاوی نیتروژن (تا 15٪ K) و فسفر (تا 58٪ P 2 O 5) به شکل NH 4 H 2 PO 4 و (NH4) 2 NRO 4. از خنثی سازی اسید فسفریک با آمونیاک بدست می آید.
نتیجه
و در پایان می خواهم بگویم اهمیت بیولوژیکی فسفر فسفر بخشی جدایی ناپذیر از بافتهای موجودات انسانی ، حیوانی و گیاهی است. در بدن انسان ، بیشتر فسفر با کلسیم در ارتباط است. کودک به اندازه کلسیم به فسفر احتیاج دارد تا اسکلت خود را بسازد. علاوه بر استخوان ، فسفر در بافتهای عصبی و مغزی ، خون ، شیر نیز یافت می شود. در گیاهان ، مانند حیوانات ، فسفر بخشی از پروتئین ها است.
از ورود فسفر به بدن انسان با غذا ، عمدتا با تخم مرغ ، گوشت ، شیر و نان ، ATP ساخته می شود - اسید آدوزین تری فسفریک ، که به عنوان جمع کننده و حامل انرژی و همچنین اسیدهای نوکلئیک عمل می کند - DNA و RNA ، که خصوصیات ارثی بدن را انتقال می دهد. ATP بیشتر در اعضای فعال بدن: در کبد ، عضلات و مغز مصرف می شود. جای تعجب نیست که معدن شناس معروف ، یکی از بنیانگذاران علم ژئوشیمی ، آکادمیست AE Fersman فسفر را "عنصری از زندگی و اندیشه" خواند.
همانطور که گفته شد ، فسفر در طبیعت به صورت ترکیبات موجود در خاک (یا محلول در آبهای طبیعی) وجود دارد. فسفر توسط گیاهان از خاک استخراج می شود و حیوانات از غذای گیاهان فسفر دریافت می کنند. پس از مرگ ارگانیسم های گیاهی و جانوری ، فسفر دوباره به خاک می رود. چرخه فسفر به این ترتیب در طبیعت انجام می شود.
لیست کتابشناسی:
1. اخمتوف NS شیمی پایه 9: کتاب درسی. برای آموزش عمومی مطالعه. مسسات - ویرایش دوم - م.: آموزش و پرورش ، 1999. - 175 ص.: بیمار
2. گابریلیان O.S. شیمی پایه 9: کتاب درسی. برای آموزش عمومی مطالعه. مسسات - ویرایش 4 - م.: بوستارد ، 2001. - 224 ص.: بیمار
3. گابریلیان O.S. شیمی پایه های 8-9: روش. کمک هزینه - ویرایش 4 - م.: بوستارد ، 2001. - 128 ص
4. اروشین D.P. ، شیشکین E.A. روش شناسی برای حل مسائل شیمی: کتاب درسی. کمک هزینه - م.: آموزش و پرورش ، 1989. - 176 ص.: بیمار
5. Kremenchug M. شیمی: کتاب مرجع یک دانش آموز. - م.: فیلول. انجمن "SLOVO": LLC "انتشارات AST" ، 2001. - 478 ص.
6. Kritsman V.A. خواندن کتاب شیمی معدنی. - م.: آموزش و پرورش ، 1986. - 273 ص
تنوع اسیدهای اکسیژنیک فسفر به دلایل زیر ایجاد می شود: 3. در تمام هیدروکسیدها ، فسفر تعداد هماهنگی 4 را نشان می دهد ، چنین هیدروکسیدهایی برای آن پایدارتر هستند ، اگر اتم اکسیژن کافی نباشد ، سپس یک پیوند P-H ((HO) 2 PHO ، نه P (OH) 3 و غیره) تشکیل می شود. 4- اسیدهای فسفریک تمایل به تشکیل پلیمرهای خطی یا حلقوی دارند. 5- تحت شرایط خاص ، تشکیل پیوند P-P امکان پذیر است. 6. همانطور که برای همه هیدروکسیدها ، اسیدهای پراکسو با اکسیداسیون بیشتر تشکیل می شوند. در اینجا ساختار و خواص معروف ترین اسیدهای فسفر است.
H 3 PO 4 - اسید ارتوفسفریک. این یک اسید ترابازیک است ، در مرحله اول در تفکیک متوسط \u200b\u200bاست (K a \u003d 7.52. 10 -3) و در دو مرحله دیگر ضعیف است. در حالت بی آب ، کریستالهای مرطوب رطوبت با t pl \u003d 42 درجه سانتی گراد را تشکیل می دهد. در هر غلظت در آب حل می شود. اسید ارتو فسفریک با حل شدن اکسید فسفر (V) در آب ، با سوزاندن فسفین ، با اکسید کردن هر نوع فسفر در یک محیط اسیدی ، با هیدرولیز ترکیبات فسفر دوتایی بدست می آید: P 4 S 10 + 16H 2 O \u003d 4H 3 PO 4 + 10H 2 S. در صنعت ، از روش احتراق فسفر با انحلال اکسید بعدی و همچنین جابجایی اسید ارتو فسفریک از فسفات کلسیم با اسید سولفوریک غلیظ هنگام گرم شدن استفاده می شود: Ca 3 (PO 4) 2 + 3H 2 SO 4 \u003d 3CaSO 4 ↓ + 2H 3 PO 4. این اسید مربوط به سه سری نمک است - متوسط \u200b\u200b(فسفات ها یا ارتو فسفات ها) و اسیدی (فسفات هیدروژن و فسفات های هیدروژن دی هیدروژن). فسفاتها و هیدروژن فسفاتهای کلیه فلزات ، به جز سدیم ، پتاسیم ، روبیدیوم و سزیم ، در آب محلول نیستند. فسفات های هیدروژن محلول هستند. فسفاتهای محلول تحت هیدرولیز آنیونی قوی قرار می گیرند ، بالاترین ثابت هیدرولیز آنیون فسفات و کمترین آن فسفات دی هیدروژن است. هیدرولیز آنیونی منجر به یک ماده قلیایی محلول نمک می شود. آنیونهای اسیدی ، همزمان با هیدرولیز ، در تعادل تفکیک ، که منجر به یک محلول اسیدی می شود ، برای دی هیدروژن فسفات تا حد بیشتری ، برای هیدروفسفات تا حد کمتری در تعادل شرکت می کنند. در نتیجه این فرآیندها ، محلول سدیم دی هیدروژن فسفات دارای یک محیط اسیدی ضعیف است ، محلول هیدروفسفات کمی قلیایی است و محلول فسفات دارای یک محیط به شدت قلیایی است. آمونیوم فسفات ، به عنوان نمکی که توسط اسیدها و بازهای ضعیف تشکیل می شود ، به طور کامل توسط آب تجزیه می شود. ارتوفسفاتها در دماهای بسیار بالا بدون تجزیه ذوب می شوند. هیدروفسفاتها وقتی گرم می شوند دی فسفات می دهند: 2K 2 HPO 4 \u003d K 4 P 2 O 7 + H 2 O. هنگام گرم شدن ، فسفات دی هیدروژن به پلی متافسفات تبدیل می شود: xKH 2 PO 4 \u003d (KPO 3) x + H 2 O. فسفات خاصیت اکسیداسیون قوی ندارند ، اما هنگام گرم شدن می تواند با کربن کاهش یابد. در حضور دی اکسید سیلیکون ، این واکنش منجر به تولید فسفر می شود (معادله واکنش داده شد) ؛ در غیاب SiO2 ، روند به شرح زیر ادامه می یابد: Ca 3 (PO 4) 2 + 8C \u003d Ca 3 P 2 + 8CO. حرارت دادن فسفات آمونیوم منجر به از دست رفتن تدریجی مولکول های آمونیاک می شود و در نهایت اسید پلی متافسفریک در دمای بالاتر از 300 درجه سانتیگراد تشکیل می شود.
در طی کمبود آب اسید ارتو فسفریک ، اسیدهای فسفریک متراکم تشکیل می شود که حاوی یک یا چند اتم اکسیژن پلی است. در این حالت ساختارهای زنجیره ای ، حلقوی و مختلط تشکیل می شود. بیایید ساده ترین آنها را در نظر بگیریم.
اسید دی فسفریک (پیرو فسفریک) - Н 4 Р 2 О 7.وقتی اسید ارتو فسفریک تا دمای 200 درجه سانتیگراد گرم می شود ، مشخص می شود که در حالت بی آب ، این بلورهای بی رنگ با t pl \u003d 61 درجه سانتیگراد هستند که به راحتی در آب حل می شوند و اسید بسیار قوی تری نسبت به اسید ارتو فسفریک تشکیل می دهند. این اسید به ویژه در دو مرحله اول قوی است. هر اسید تغلیظ شده از یک اسید قوی تر است ، زیرا در هنگام تفکیک آنیون پایدارتری بدست می آید. محلول های اسید پیرو فسفریک ناپایدار هستند ، زیرا به تدریج یک مولکول آب برای تشکیل دو مولکول اسید ارتو فسفریک اضافه می شود. نمک - پیرو فسفاتها ، که همانطور که قبلاً ذکر شد ، با گرم کردن فسفات هیدروژن می توان بدست آورد ، پایدارتر هستند.
اسیدهای متافسفریک - (HPO 3) x ، جایی که x \u003d 3،4،6.اسیدهای چگال حلقوی حاوی چرخه ای از اتم های فسفر و اکسیژن متناوب. با محلول اکسید فسفر (V) در اسید فسفریک و همچنین با گرم کردن اسید پیرو فسفریک تا 300 درجه سانتیگراد بدست می آیند: 3H 4 P 2 O 7 \u003d 2 (HPO 3) 3 + H 2 O. تمام اسیدهای متافسفریک برای اسید تری متافسفریک بسیار قوی هستند K a2 \u003d 0.02. همه این اسیدها نیز در هستند محلول آبی به تدریج به اسید ارتو فسفریک تبدیل می شود. نمکهای آنها به ترتیب تری- ، تترا- و هگزامتافسفات نامیده می شوند.
اکسیداسیون اکسید فسفر (V) را می توان بدست آورد اسید پراکسوفسفریک: P 4 O 10 + 4H 2 O 2 + 2H 2 O \u003d 4H 3 PO 5.
اسید فسفریک (هیپوفسفر) Н 4 Р 2 О 6این دارد ارتباط R-R... فرمول ساختاری را می توان به عنوان (OH) 2 OP-PO (OH) 2 نشان داد. از فرمول می توان دریافت که ظرفیت فسفر 5 است و حالت اکسیداسیون 4+ یک مقدار رسمی است که با وجود پیوند بین اتمهای یکسان مرتبط است. این یک اسید تترابازیک است که قدرت آن با ارتوفسفریک مطابقت دارد. با واکنش بدست می آید: PbP 2 O 6 + 2H 2 S \u003d 2PbS ↓ + H 4 P 2 O 6 و به صورت دی هیدرات با t pl \u003d 62 درجه سانتیگراد از محلول آزاد می شود. در محلول اسیدی با اسیدهای فسفر و فسفر متناسب نیست.
اسید فسفر H 3 PO 3 یا H 2.این یک اسید دوبازیک با مقاومت متوسط \u200b\u200bاست ، در حالت بی آب یک جامد با t pl \u003d 74 درجه سانتیگراد است. این با هیدرولیز هالیدهای فسفر (III) و همچنین با اکسیداسیون فسفر سفید با کلر در زیر آب بدست می آید: P 4 + 6Cl 2 + 12H 2 O \u003d 4H 2 + 12HCl. همانطور که در بالا ذکر شد ، ترکیب ترکیب P (OH) 3 از ثبات کمتری برخوردار است ؛ بنابراین ، با تشکیل ، ایزومریزاسیون رخ می دهد ارتباط R-N، که در یک محلول آبی جدا نمی شود. نمک های اسید فسفر را فسفیت ، نمک های اسیدی را هیدروفسفیت می نامند. بیشتر فسفیت ها (به جز نمک های فلز قلیایی) در آب نامحلول هستند. مانند تمام ترکیبات فسفر (III) ، اسید فسفر یک عامل کاهنده قوی است ، توسط هالوژن ها ، دی اکسید نیتروژن و سایر مواد اکسید کننده به اسید فسفریک اکسید می شود و همچنین فلزات کم کار را از محلول نمک های آنها کاهش می دهد ، به عنوان مثال: HgCl 2 + H 2 + H 2 O \u003d H 3 PO 4 + 2HCl + Hg When. در صورت گرم شدن ، متناسب نیست: 4H 2 \u003d 3H 3 PO 4 + PH 3.
اسید هیپوفسفر (فسفینیک) H 3 PO 2 یا H این یک جامد با t pl \u003d 26.5 درجه سانتیگراد است که محلول آبی آن یک اسید مونوبازیک نسبتاً قوی (K a \u003d 7.9. 10 -2 -2) است. فسفر موجود در این ترکیب نیز دارای پنج پیوند است که دو پیوند با اتم های هیدروژن است. فقط پیوند H-O تحت تجزیه قرار می گیرد. حالت اکسیداسیون رسمی فسفر در این ترکیب 1+ است. اسید هیپوفسفر و نمک های آن - هایفوفسفیت ها - عوامل کاهنده قوی هستند. کاتیونهای فلزی ، حتی آنهایی که در سری ولتاژهای مقابل هیدروژن ایستاده اند ، قادر به تبدیل شدن به فلز هستند: NiCl 2 + Na + 2H 2 O \u003d H 3 PO 4 + HCl + NaCl + H 2 + Ni. هنگام گرم شدن ، اسید فسفر نامتناسب است: 3H \u003d PH 3 + 2H 2. با افزایش دما ، نشان داده شده است که اسید فسفر نیز به اسید فسفر و فسفین تجزیه می شود. هیپوفسفرهای فلزات قلیایی و قلیایی با تعامل فسفر و قلیایی بدست می آیند (به بالا نگاه کنید). اکسیداسیون فسفین با یک اکسیدان ملایم: PH 3 + SO 2 \u003d H + S ↓ (کاتالیزورها - جیوه و آثار آب).
فسفر هالید PX 3 و PX 5
همه هالیدهای فسفر به جز PJ 5 شناخته شده اند. در مورد فسفر (III) ، اینها مولکولهای هرمی با اتم فسفر در راس و با زاویه بین پیوندهای P-X برابر با 100 درجه هستند. فسفر (V) هالیدها دو پیرامیدهای تریگونال با ترکیبی از sp 3 d از اوربیتالهای اتمی فسفر هستند. در شرایط عادی ، هر دو فلورید فسفر گاز ، PCl 3 و PBr 3 مایعات هستند و تری یدید ، پنتاکلراید و پنتابرومید جامد هستند. دو ترکیب آخر نمکهایی با یونهای پیچیده PCl 5: + - ، PBr 5: + Br - هستند. با گرم شدن ، هر دو ترکیب مولکول هالوژن را شکافته و به تری هالید تبدیل می شوند. هالیدهای فسفر از طریق سنتز مستقیم بدست می آیند. فقط PF 3 - به طور غیرمستقیم: PCl 3 + AsF 3 \u003d PF 3 + AsCl 3. همه هالیدهای فسفر در معرض هیدرولیز هستند و تری هالیدها همچنین قادر به اکسیداسیون هستند: 2PCl 3 + O 2 \u003d 2POCl 3 - اکسی کلرید فسفر را می توان با واکنش های دیگر بدست آورد: PCl 3 + 2CrO 3 \u003d POCl 3 + Cr 2 O 3 ↓ + O 2 6PCl 5 + P 4 O 10 \u003d 10POCl 3. تری هالیدها همچنین گوگرد اضافه می کنند: PCl 3 + S \u003d PSCl 3. در محلولهای غیرآبی واکنش امکان پذیر است: KF + PF 5 \u003d K HF (مایع) + PF 5 \u003d H - اسید هگزافلوروفسفریک ، فقط در محلول آبی پایدار ، از نظر قدرت با اسید پرکلریک قابل مقایسه است.
فسفر و ترکیبات آن
مقدمه
فصل I. فسفر به عنوان یک عنصر و به عنوان یک ماده ساده
1.1 فسفر در طبیعت
1.2 مشخصات فیزیکی
1.3 خواص شیمیایی
1.4. دریافت کردن
1.5 کاربرد
فصل دوم ترکیبات فسفر
2.1 اکسیدها
2.2. اسیدها و نمک های آنها
2.3 فسفین
فصل سوم کودهای فسفاته
نتیجه
لیست کتابشناسی
مقدمه
فسفر (فسفر لاتین) P عنصر شیمیایی گروه V سیستم تناوبی عدد اتمی 15 مندلیف ، جرم اتمی 30.973762 30 (4) است. ساختار اتم فسفر را در نظر بگیرید. در سطح انرژی بیرونی اتم فسفر پنج الکترون وجود دارد. از لحاظ گرافیکی ، به این شکل است:
1s 2 2s 2 2پ 6 3s 2 3پ 3 3د 0

در سال 1699 ، کیمیاگر هامبورگ X. برند ، در جستجوی "سنگ فیلسوف" ، که ظاهراً قادر به تبدیل فلزات اساسی به طلا است ، هنگام تبخیر ادرار با زغال سنگ و شن و ماسه ، یک ماده مومی سفید را قادر به درخشش جدا کرد.
نام "فسفر" از یونانی آمده است. "Phos" - نور و "phoros" - حامل. در روسیه اصطلاح "فسفر" در سال 1746 توسط M.V. لومونوسوف
ترکیبات اصلی فسفر شامل اکسیدها ، اسیدها و نمک های آنها (فسفات ، فسفات دی هیدروژن ، فسفات هیدروژن ، فسفید ، فسفیت) است.
کودها حاوی بسیاری از مواد حاوی فسفر هستند. به چنین کودهایی کودهای فسفره گفته می شود.
فصلمن فسفر به عنوان یک عنصر و به عنوان یک ماده ساده
1.1 فسفر در طبیعت
فسفر یکی از عناصر رایج است. محتوای کل پوسته زمین حدود 0.08٪ است. فسفر به دلیل قابلیت اکسیداسیون آسان در طبیعت فقط به صورت ترکیبات یافت می شود. مواد معدنی اصلی فسفر فسفریت و آپاتیت هستند ؛ از دومی ، فلوراپاتیت 3Ca3 (PO 4) 2 CaF2 گسترده ترین است. فسفریت ها در اورال ، منطقه ولگا ، سیبری ، قزاقستان ، استونی و بلاروس بسیار گسترده هستند. بزرگترین ذخایر آپاتیت در شبه جزیره کولا واقع شده است.
فسفر یکی از عناصر اساسی موجودات زنده است. در استخوان ها ، عضلات ، بافت مغز و اعصاب وجود دارد. مولکول های ATP از فسفر ساخته می شوند - اسید آدنوزین تری فسفریک (ATP یک جمع کننده و حامل انرژی است). بدن یک فرد بالغ به طور متوسط \u200b\u200bحدود 4.5 کیلوگرم فسفر دارد که عمدتا در ترکیب با کلسیم است.
فسفر در گیاهان نیز یافت می شود.
فسفر طبیعی تنها از یک ایزوتوپ پایدار تشکیل شده است ، 31 R. امروز شش ایزوتوپ رادیواکتیو فسفر شناخته شده است.
1.2 خواص فیزیکی
فسفر دارای چندین تغییر آلوتروپیک است - فسفر سفید ، قرمز ، سیاه ، قهوه ای ، بنفش و غیره. سه مورد اول بیشترین مطالعه را دارند.
فسفر سفید - بی رنگ ، با ماده بلوری مایل به زرد ، در تاریکی می درخشد. تراکم آن 1.83 گرم در سانتی متر مکعب است. این در آب حل نمی شود ، در دی سولفید کربن به خوبی حل می شود. بوی سیر مشخصی دارد. نقطه ذوب 44 درجه سانتیگراد ، دمای احتراق خودکار 40 درجه سانتیگراد. برای محافظت از فسفر سفید در برابر اکسیداسیون ، در تاریکی زیر آب ذخیره می شود (در نور به فسفر قرمز تبدیل می شود). در سرما ، فسفر سفید شکننده است ، در دمای بالاتر از 15 درجه سانتیگراد نرم می شود و با چاقو بریده می شود.
مولکولهای فسفر سفید دارای یک شبکه بلوری هستند که در گره های آن مولکولهای P4 به صورت چهار ضلعی وجود دارد.
هر اتم فسفر توسط سه پیوند σ به سه اتم دیگر پیوند می خورد.
فسفر سفید سمی است و سوختگی های سخت ترمیم می کند.
فسفر قرمز– یک ماده پودری از رنگ قرمز و تیره بدون بو ، در آب و دی سولفید کربن حل نمی شود ، درخشان نمی شود. دمای احتراق 260 درجه سانتیگراد ، تراکم 2.3 گرم در سانتی متر 3. فسفر قرمز مخلوطی از چندین تغییر آلوتروپیک است که از نظر رنگ متفاوت است (از قرمز به بنفش). خصوصیات فسفر قرمز به شرایط تولید آن بستگی دارد. سمی نیست
فسفر سیاهاز نظر ظاهری شبیه به گرافیت ، چرب با لمس ، دارای خصوصیات نیمه رسانا است. تراکم 2.7 گرم در سانتی متر 3.
فسفر قرمز و سیاه دارای شبکه بلوری اتمی است.
1.3 خواص شیمیایی
فسفر غیر فلزی است. در ترکیبات ، معمولاً حالت اکسیداسیون 5+ نشان می دهد ، کمتر - 3 و –3 (فقط در فسفیدها).
واکنش با فسفر سفید آسان تر از فسفر قرمز است.
تعامل با مواد ساده.
1. تعامل با هالوژن ها:
2P + 3Cl 2 \u003d 2PCl 3 (کلرید فسفر (III)) ،
PCl 3 + Cl 2 \u003d PCl 5 (فسفر (V) کلرید).
2. تعامل با نماتال ها:
2P + 3S \u003d P 2 S 3 (فسفر (III) سولفید.
3. تعامل با فلزات:
2P + 3Ca \u003d Ca 3 P 2 (فسفید کلسیم).
4- تعامل با اکسیژن:
4P + 5O 2 \u003d 2P 2 O 5 (اکسید فسفر (V) ، آنیدرید فسفر).
دوم تعامل با مواد پیچیده
1.4 به دست آوردن
فسفر از فسفریت خرد شده و آپاتیت بدست می آید ، دومی با زغال سنگ و شن مخلوط می شود و در کوره های 1500 درجه سانتیگراد کلسینه می شود:
2Ca 3 (PO 4) 2 + 10C + 6SiO 2 6CaSiO 3 + P 4 + 10CO.
فسفر به صورت بخار آزاد می شود که در گیرنده زیر آب متراکم می شود و فسفر سفید ایجاد می کند.
هنگامی که بدون دسترسی هوا در دمای 300-350 درجه سانتی گراد گرم می شود ، فسفر سفید به قرمز تبدیل می شود.
فسفر سیاه با گرم شدن طولانی مدت فسفر سفید در فشارهای بسیار زیاد (200 درجه سانتیگراد و 1200 مگاپاسکال) بدست می آید.
1.5 برنامه
از فسفر قرمز در ساخت کبریت استفاده می شود (تصویر را ببینید). این بخشی از مخلوطی است که در کنار جعبه کبریت استفاده می شود. جز component اصلی ترکیب سر کبریت نمک برتولت KClO 3 است. از اصطکاک سر مسابقه در برابر گسترش جعبه ، ذرات فسفر در هوا مشتعل می شوند. در نتیجه واکنش اکسیداسیون فسفر ، گرما آزاد می شود و منجر به تجزیه نمک برتولت می شود.

اکسیژن حاصل به احتراق سر کبریت کمک می کند.
از فسفر در متالورژی استفاده می شود. برای بدست آوردن رساناها استفاده می شود و بخشی از برخی از مواد فلزی مانند برنزهای قلع است.
فسفر همچنین در تولید اسید فسفرریک و مواد شیمیایی سمی (دی کلروس ، کلروفوس و غیره) استفاده می شود.
از فسفر سفید برای ایجاد صفحات نمایش دود استفاده می شود ، زیرا هنگام سوختن دود سفید تولید می کند.
فصلدوم... ترکیبات فسفر
2.1 اکسیدها
فسفر چندین اکسید تشکیل می دهد. مهمترین آنها اکسید فسفر (V) P 4 O 10 و اکسید فسفر (III) P 4 O 6 است. اغلب فرمول های آنها به صورت ساده نوشته می شوند - P 2 O 5 و P 2 O 3. ساختار این اکسیدها آرایش چهار وجهی اتم های فسفر را حفظ می کند.
اکسید فسفر (III) P 4 O 6 توده بلوری مومی است که در 22.5 درجه سانتیگراد ذوب می شود و به مایع بی رنگ تبدیل می شود. سمی
وقتی در آب سرد حل می شود ، اسید فسفر تشکیل می دهد:
P 4 O 6 + 6H 2 O \u003d 4H 3 PO 3 ،
و هنگام واکنش با مواد قلیایی ، نمک های مربوطه (فسفیت ها).
عامل کاهنده قوی. هنگام تعامل با اکسیژن ، آن را به P 4 O 10 اکسید می کنند.
اکسید فسفر (III) با اکسیداسیون فسفر سفید با کمبود اکسیژن بدست می آید.
اکسید فسفر (V) P 4 O 10 یک پودر کریستالی سفید است. دمای تصعید 36 درجه سانتیگراد است. چندین تغییر دارد که یکی از آنها (اصطلاحاً فرار) دارای ترکیب P4 O 10 است. شبکه کریستالی این اصلاحات از مولکولهای P4O10 تشکیل شده است ، که توسط نیروهای ضعیف بین مولکولی به هم پیوسته اند و با گرم شدن به راحتی از هم جدا می شوند. از این رو نوسانات این گونه است. سایر تغییرات پلیمری است. آنها توسط لایه های بی پایان PO 4 tetrahedra تشکیل شده اند.
هنگامی که P 4 O 10 با آب ارتباط برقرار می کند ، اسید فسفریک تشکیل می شود:
P 4 O 10 + 6H 2 O \u003d 4H 3 PO 4.
به عنوان یک اکسید اسیدی ، P 4 O 10 با اکسیدهای اساسی و هیدروکسیدها واکنش نشان می دهد.
این ماده در طی اکسیداسیون فسفر در دمای بالا و بیش از حد اکسیژن (هوای خشک) تشکیل می شود.
از اکسید فسفر (V) به دلیل خاصیت رطوبتی فوق العاده ای که دارد ، در فناوری آزمایشگاهی و صنعتی به عنوان ماده خشک کننده و کم آب استفاده می شود. از نظر اثر خشک کردن ، از همه مواد دیگر پیشی می گیرد. آب پیوند خوراکی شیمیایی را از اسید پرکلریک بی آب گرفته و آن را تشکیل می دهد:
4HClO 4 + P 4 O 10 \u003d (HPO 3) 4 + 2Cl 2 O 7.
2.2 اسیدها و نمک های آنها
و) اسید فسفر H 3 PO 3. اسید فسفره بی آب H3 PO 3 بلورهایی با تراکم 65/1 گرم در سانتی متر مکعب تشکیل می دهد که در دمای 74 درجه سانتیگراد ذوب می شوند.
فرمول ساختاری:
هنگامی که H3 PO 3 بی آب گرم می شود ، یک واکنش نامتناسب (خود اکسیداسیون-خود ترمیم) ایجاد می شود:
4H 3 PO 3 \u003d PH 3 + 3H 3 PO 4.
نمکهای اسید فسفر - فسفیت... به عنوان مثال ، K 3 PO 3 (فسفیت پتاسیم) یا Mg 3 (PO 3) 2 (فسفیت منیزیم).
اسید فسفر H 3 PO 3 با حل شدن اکسید فسفر (III) در آب یا هیدرولیز کلرید فسفر (III) РCl3 بدست می آید:
РCl 3 + 3H 2 O \u003d H 3 PO 3 + 3HCl.
ب) اسید فسفریک (اسید orthophosphoric) H 3 PO 4.
اسید فسفریک بی آب یک کریستال شفاف سبک است که در دمای اتاق در هوا پخش می شود. نقطه ذوب 42.35 درجه سانتیگراد با آب ، اسید فسفریک محلولهای هر غلظت را تشکیل می دهد.
اسید فسفریک فرمول ساختاری زیر را دارد:
اسید فسفریک با فلزات واقع در محدوده پتانسیل الکترود استاندارد تا هیدروژن ، با اکسیدهای اساسی ، با بازها و نمک های اسیدهای ضعیف واکنش می دهد.
در آزمایشگاه ، اسید فسفر از اکسیداسیون فسفر با اسید نیتریک 30٪ بدست می آید:
3P + 5HNO 3 + 2H 2 O \u003d 3H 3 PO 4 + 5NO.
در صنعت ، اسید فسفریک به دو روش استخراج و حرارتی تولید می شود. در قلب روش استخراجدرمان فسفات طبیعی خرد شده با اسید سولفوریک است:
Ca 3 (PO 4) 2 + 3H 2 SO 4 \u003d 2H 3 PO 4 + 3CaSO 4.
سپس اسید فسفریک با تبخیر فیلتر شده و غلیظ می شود.
روش حرارتیدر کاهش فسفات طبیعی به فسفر آزاد ، و به دنبال آن احتراق به Р4О10 و انحلال دومی در آب وجود دارد. اسید فسفریک تولید شده توسط این روش با خلوص بالاتر و افزایش غلظت (تا 80٪ از نظر وزنی) مشخص می شود.
اسید فسفریک برای تولید کودها ، برای تهیه معرف ها ، مواد آلی ، برای ایجاد پوشش های محافظ روی فلزات استفاده می شود. اسید فسفریک خالص برای تهیه داروها ، مواد غذایی کنسانتره مورد نیاز است.
اسید فسفریک یک اسید قوی نیست. به عنوان یک اسید تریکاریزیک ، به صورت مرحله ای در محلول آبی جدا می شود. تفکیک در مرحله اول آسان تر است.
1. H 3 PO 4 H + + (یون فسفات دی هیدروژن) ؛
2. H + + (یون هیدروژن فسفات) ؛
3. H + + (یون فسفات).
معادله یونی کل برای تفکیک اسید فسفریک:
H 3 PO 4 3H + +.
اسید فسفریک سه سری نمک تشکیل می دهد:
الف) K 3 PO 4 ، Ca 3 (PO 4) 2 - جایگزین شده یا فسفاتها ؛
ب) K 2 HPO 4 ، CaHPO 4 - فسفاتهای جایگزین شده یا هیدروژن؛
ج) KH 2 PO 4 ، Ca (H 2 PO 4) 2 - فسفاتهای مونو جایگزین یا دی هیدروژن.
فسفاتهای یک جایگزین واکنش اسیدی دارند ، فسفاتهای جایگزین نشده ضعیف قلیایی و مواد جایگزین شده سه قلیایی هستند.
تمام فسفاتهای فلز قلیایی و آمونیوم محلول در آب هستند. از نمک های کلسیم اسید فسفریک ، فقط کلسیم دی هیدروژن فسفات در آب حل می شود. کلسیم هیدروژن فسفات و کلسیم فسفات محلول در اسیدهای آلی هستند.
هنگامی که گرم می شود ، اسید فسفریک ابتدا آب را از دست می دهد - یک حلال ، سپس دهیدراته شدن اسید فسفریک شروع می شود و اسید دی فسفریک تشکیل می شود:
2H 3 PO 4 \u003d H 4 P 2 O 7 + H 2 O.
قسمت قابل توجهی از اسید فسفریک در دمای حدود 260 درجه سانتیگراد به اسید دی فسفریک تبدیل می شود.
که در) اسید فسفریک (اسید هیپوفسفریک) H 4 P 2 O 6.
 .
.
H 4 P 2 O 6 یک اسید تترابازیک با مقاومت متوسط \u200b\u200bاست. در حین ذخیره سازی ، اسید هیپوفسفریک به تدریج تجزیه می شود. با گرم شدن محلولهای آن به H 3 PO 4 و H 3 PO 3 تبدیل می شود.
این ماده در اثر اکسیداسیون آهسته Н3 РО3 در هوا یا اکسیداسیون فسفر سفید در هوای مرطوب تشکیل می شود.
د) اسید هیپوفسفر (اسید هیپوفسفر) H 3 PO 2. این اسید تک پایه ، قوی است. اسید هیپوفسفر با فرمول ساختاری زیر مطابقت دارد:
 .
.
هیپوفسفیت– نمک های اسید هیپوفسفر - معمولاً بسیار محلول در آب است.
Hypophosphites و H 3 PO 2 عوامل کاهنده انرژی هستند (به ویژه در یک محیط اسیدی). ویژگی ارزشمند آنها توانایی کاهش نمک های محلول برخی از فلزات (Ni ، Cu و غیره) به فلز آزاد است:
2Ni 2+ + + 2H 2 O → Ni 0 + + 6H +.
اسید هیپوفسفر از تجزیه هیپوفسفیتهای کلسیم یا باریم با اسید سولفوریک بدست می آید:
Ba (H 2 PO 2) 2 + H 2 SO 4 \u003d 2H 3 PO 2 + BaSO 4.
هیپوفسفیت ها با جوشاندن فسفر سفید در سوسپانسیون هیدروکسیدهای کلسیم یا باریم تشکیل می شوند.
2P 4 (سفید) + 3Ba (OH) 2 + 6H 2 O \u003d 2PH 3 + 3Ba (H 2 PO 2) 2.
2.3 فسفین
فسفین PH 3 - ترکیبی از فسفر با هیدروژن - یک گاز بی رنگ با بوی نامطبوع سیر ، به راحتی در آب قابل حل است (با آن واکنش شیمیایی ندارد) و بسیار سمی است. در هوا ، فسفین خالص و خشک هنگام حرارت دادن بالاتر از 100-140 درجه سانتیگراد مشتعل می شود. اگر فسفین حاوی ناخالصی های دی فسفین P 2 H 4 باشد ، خود به خود در هوا مشتعل می شود.
هنگام تعامل با برخی از اسیدهای قوی ، فسفین تشکیل می شود نمکهای فسفونیوم ،به عنوان مثال:
PH 3 + HCl \u003d PH 4 Cl (کلرید فسفونیوم).
ساختار کاتیون فسفونیوم [PH 4] + شبیه ساختار کاتیون آمونیوم است.
آب نمک های فسفونیوم را تجزیه کرده و فسفین و هیدروژن هالید تشکیل می دهد.
فسفین را می توان با تعامل فسفیدها با آب بدست آورد:
Ca 3 P 2 + 6H 2 O \u003d 3Ca (OH) 2 + 2PH 3.
و آخرین چیز هنگامی که فسفر با فلزات برهم کنش دارد ، نمکها تشکیل می شوند - فسفیدها... به عنوان مثال ، Ca 3 P 2 (فسفید کلسیم) ، Mg 3 P 2 (فسفید منیزیم).
فصلIII کودهای فسفاته
ترکیبات فسفر ، و همچنین نیتروژن ، به طور مداوم در طبیعت متحول می شوند - چرخه فسفر در طبیعت اتفاق می افتد. گیاهان فسفات را از خاک استخراج کرده و آنها را به مواد آلی پیچیده حاوی فسفر تبدیل می کنند. این مواد با غذای گیاهی وارد بدن حیوانات می شوند - تشکیل مواد پروتئینی بافت های عصبی و عضلانی ، فسفات کلسیم در استخوان ها و ... پس از مرگ حیوانات و گیاهان ، ترکیبات حاوی فسفر تحت اثر میکروارگانیسم ها تجزیه می شوند. در نتیجه ، فسفات ها تشکیل می شوند. بنابراین ، چرخه کامل می شود ، که توسط طرح بیان می شود:
P (موجودات زنده) P (خاک).
با حذف ترکیبات فسفر از محصولات کشاورزی ، این چرخه مختل می شود. کمبود فسفر در خاک عملاً دوباره پر نمی شود به طور طبیعی... بنابراین لازم است از کودهای فسفره استفاده شود.
همانطور که می دانید ، کودهای معدنی ساده و پیچیده هستند. کودهای ساده شامل کودهای حاوی یک ماده مغذی هستند. کودهای پیچیده حاوی چندین ماده مغذی هستند.
کودهای فسفاته چگونه در صنعت به دست می آیند؟ فسفاتهای طبیعی در آب حل نمی شوند و در محلولهای خاک محلول ضعیف هستند و گیاهان ضعیف جذب می کنند. فرآوری فسفاتهای طبیعی به ترکیبات محلول در آب وظیفه صنایع شیمیایی است. محتوای عنصر غذایی فسفر در کود توسط محتوای اکسید فسفر (V) P 2 O 5 تخمین زده می شود.
جز component اصلی کودهای فسفره کلسیم دی هیدرو یا هیدروژن فسفات است. فسفر در بسیاری از ترکیبات آلی گیاهان یافت می شود. تغذیه فسفر رشد و نمو گیاه را تنظیم می کند. رایج ترین کودهای فسفاته عبارتند از:
1. آرد فسفریت- پودر سفید خوب. حاوی 18-26٪ Р 2 О 5 است.
این ماده با آسیاب کردن فسفریت های Ca 3 (PO 4) 2 بدست می آید.
آرد فسفریت فقط در خاکهای podzolic و ذغال سنگ نارس حاوی اسیدهای آلی قابل جذب است.
2. سوپرفسفات ساده- پودر دانه ریز خاکستری. حاوی 20٪ Р 2 О 5.
با تعامل فسفات طبیعی با اسید سولفوریک بدست می آید:
Ca 3 (PO 4) 2 + 2H 2 SO 4 \u003d Ca (H 2 PO 4) 2 + 2CaSO 4.
سوپرفسفات
در این حالت ، مخلوطی از نمک های Ca (H 2 PO 4) 2 و CaSO 4 بدست می آید که به خوبی توسط گیاهان در هر خاکی جذب می شود.
3. سوپرفسفات دوتایی(رنگ و ظاهری شبیه سوپرفسفات ساده).
این ماده با تأثیر بر فسفات اسید فسفریک طبیعی بدست می آید:
Ca 3 (PO 4) 2 + 4H 3 PO 4 \u003d 3Ca (H 2 PO 4) 2.
در مقایسه با سوپرفسفات ساده ، حاوی CaSO4 نیست و کود بسیار غلیظ تری است (حاوی 50٪ P 2 O 5 است).
4. بارش باران- حاوی 35-40٪ Р 2 О 5.
این ماده با خنثی سازی اسید فسفریک با محلول هیدروکسید کلسیم بدست می آید:
H 3 PO 4 + Ca (OH) 2 \u003d CaHPO 4 2H 2 O.
در خاکهای اسیدی استفاده می شود.
5. آرد استخوان... این ماده با پردازش استخوان های حیوانات اهلی بدست می آید ، حاوی Ca3 (PO 4) 2 است.
6. آموفوس- کود پیچیده حاوی نیتروژن (تا 15٪ K) و فسفر (تا 58٪ P 2 O 5) به شکل NH 4 H 2 PO 4 و (NH 4) 2 NRO 4. از خنثی سازی اسید فسفریک با آمونیاک بدست می آید.
نتیجه
و در پایان ، می خواهم اهمیت بیولوژیکی فسفر را بگویم. فسفر بخشی جدایی ناپذیر از بافتهای موجودات انسانی ، حیوانی و گیاهی است. در بدن انسان ، بیشتر فسفر با کلسیم در ارتباط است. کودک به اندازه کلسیم به فسفر احتیاج دارد تا اسکلت خود را بسازد. علاوه بر استخوان ، فسفر در بافتهای عصبی و مغزی ، خون ، شیر نیز یافت می شود. در گیاهان ، مانند حیوانات ، فسفر بخشی از پروتئین ها است.
از ورود فسفر به بدن انسان با غذا ، عمدتا با تخم مرغ ، گوشت ، شیر و نان ، ATP ساخته می شود - آدنوزین تری فسفریک اسید ، که به عنوان یک جمع کننده و حامل انرژی و همچنین اسیدهای نوکلئیک عمل می کند - DNA و RNA ، که خصوصیات ارثی بدن را انتقال می دهد. ATP بیشتر در اعضای فعال بدن: در کبد ، عضلات و مغز مصرف می شود. جای تعجب نیست که معدن شناس معروف ، یکی از بنیانگذاران علم ژئوشیمی ، آکادمیست AE Fersman فسفر را "عنصری از زندگی و اندیشه" خواند.
همانطور که گفته شد ، فسفر در طبیعت به صورت ترکیباتی موجود در خاک (یا محلول در آبهای طبیعی) وجود دارد. فسفر توسط گیاهان از خاک استخراج می شود و حیوانات از غذای گیاهان فسفر دریافت می کنند. پس از مرگ ارگانیسم های گیاهی و جانوری ، فسفر دوباره به خاک می رود. چرخه فسفر به این ترتیب در طبیعت انجام می شود.
لیست کتابشناسی:
1. اخمتوف NS شیمی پایه 9: کتاب درسی. برای آموزش عمومی مطالعه. مسسات - ویرایش دوم - م.: آموزش و پرورش ، 1999. - 175 ص.: بیمار
2. گابریلیان O.S. شیمی پایه 9: کتاب درسی. برای آموزش عمومی مطالعه. مسسات - ویرایش 4 - م.: بوستارد ، 2001. - 224 ص.: بیمار
3. گابریلیان O.S. شیمی پایه های 8-9: روش. کمک هزینه - ویرایش 4 - م.: بوستارد ، 2001. - 128 ص
4. اروشین D.P. ، شیشکین E.A. روش شناسی برای حل مسائل شیمی: کتاب درسی. کمک هزینه - م.: آموزش و پرورش ، 1989. - 176 ص.: بیمار
5. Kremenchug M. شیمی: کتاب مرجع یک دانش آموز. - م.: فیلول. جامعه "SLOVO": LLC "انتشارات AST" ، 2001. - 478 ص.
6. Kritsman V.A. خواندن کتاب شیمی معدنی. - م.: آموزش و پرورش ، 1986. - 273 ص
اطلاعات بیشتر از بخش شیمی:
- پایان نامه: مشکلات میکرو میکرو اصلاح سیستم های نانو پراکنده
- پایان نامه: انرژی هیدروژن جایگزین به عنوان عنصری از بخش شیمی مدرسه: "خواص فیزیکوشیمیایی هیدروژن"
صفحه 1
ترکیبات فسفر به طور فعال در متابولیسم گیاه نقش دارند. فسفر بخشی از اسیدهای نوکلئیک ، نوکلئوپروتئیدها ، فسفولیپیدها و آنزیم ها است. فسفات ها نقش بافرهای شیمیایی را بازی می کنند که واکنش شیره سلول را در سطح مشخصی حفظ می کنند. عملکرد فسفر و نیتروژن در یک گیاه به طور آشکار با هم مرتبط هستند ، در نتیجه ممکن است علائم کمبود این دو ماده مغذی مشابه باشد. فسفر در متابولیسم نیتروژن نقش دارد و در فرآیندهایی مانند جوانه زنی بذر ، تشکیل نهال ، رشد ریشه و رسیدن بذر و میوه نقش مهمی دارد.
ترکیبات فسفر اغلب به عنوان ناخالصی در سنگ معدن آهن یافت می شود. به صورت پودر ریز ، از این محصول به عنوان کود غنی از فسفر استفاده می شود.
ترکیبات فسفر با هیدروژن - H3P - هیدروژن فسفید و H4Pg - هیدروژن پرفسفید - به طور سنتی در ادبیات آموزشی به عنوان هیدرید در نظر گرفته می شوند.
ترکیبات فسفر در آبهای طبیعی به صورت ذرات معلق با منشا mineral معدنی و آلی ، به صورت یون های اسید فسفریک یا یک مجموعه آلی پیچیده یافت می شود. در آبهای طبیعی ، ترکیبات فسفر به مقدار کم وجود دارد ، اما تأثیر قابل توجهی روی پوشش گیاهی آبزیان دارد. غلظت ترکیبات فسفر در آب آشامیدنی تنظیم نشده است.
ترکیبات فسفر کمتر از ترکیبات نیتروژن متحرک هستند ، اما همچنین به شدت وارد آبهای سطحی و زیرزمینی ، رودخانه ها و دریاها می شوند. دوزهای بیش از حد کودهای فسفره ، شستشوی فرسایشی خاک ، رواناب در مناطق پرورشی دام - همه این منابع 60 - 70٪ فسفر وارد آب را تأمین می کنند. در همین حال ، منابع معدنی فسفر روی زمین بسیار محدود است و سوman مدیریت ذخایر آن می تواند منجر به گرسنگی فسفر در کره زمین شود. بنابراین ، مسئله استفاده صحیح از نظر محیطی از کودهای فسفره و استفاده مجدد از زباله های صنعتی حاوی فسفر در کشاورزی بسیار مهم است.
ترکیبات فسفر با انعقاد از فاضلاب استخراج می شوند. ترکیبات نیتروژن با سلب کردن ، تبادل یونی ، الکترولیز ، روش های شیمیایی یا بیولوژیکی حذف می شوند.
ترکیبات فسفر فرآیندهای اسید باز را کاتالیز می کنند: واکنش های ایزومریزاسیون ، پلیمریزاسیون ، افزودن ، جایگزینی و تجزیه. کاتالیزورها عمدتا پنتا اکسید فسفر ، اسیدهای فسفریک و مشتقات آنها هستند. استفاده از ترکیباتی مانند مشتقات فسفین ، سولفیدها ، هالیدها و اکسی هالیدهای فسفر به محدوده کوچکی از واکنش ها محدود می شود که در فاز مایع در دمای بیش از 100 درجه سانتیگراد اتفاق می افتد.
اگرچه ترکیبات فسفر تنها کاتالیزور چنین تغییراتی نیستند (اسید سولفوریک ، کاتالیزورهای Friedel-Crafts ، رسهای فعال شده و آلومینوسیلیکات های مصنوعی نیز استفاده می شوند) ، هنوز هم بیشترین کاربرد را دارند. در حضور کاتالیزورهای پشتیبانی شده ، فرآیندها عمدتا در مرحله بخار ، اغلب در محدوده دما 150-200 درجه سانتیگراد ، تحت فشار انجام می شوند. اسید فسفریک آغشته به خاک دیاتومه یا کربن فعال و همچنین به یک حامل جامد به شکل فیلم مایع اعمال می شود و از پیرو فسفات مس در کارخانه های صنعتی برای تولید پلیمرهای مایع استفاده می شود.
به نظر می رسد ترکیبات فسفر مانند کراتین فسفات برای انقباض عضلات و متابولیسم کربوهیدرات... فسفات ها همچنین نقش مهمی در تنظیم pH خون دارند. مقدار کمی فسفر اغلب در سرم خون ، بافتها و سایر اشیا biological بیولوژیکی تعیین می شود.
ترکیبات فسفر نقش مهمی در زندگی حیوانات و گیاهان دارد. آنها بخشی از برخی از مواد پروتئینی هستند ، به ویژه ، بافت عصبی و مغزی ، آنزیم ها ، ویتامین ها.
ترکیبات فسفر (که می توانند حالت اکسیداسیون داشته باشند - 3 ، 3 و 5) توسط آنها خواص شیمیایی بیشتر شبیه ترکیبات آرسنیک است تا نیتروژن. در مجتمع های فسفر تتراکوردین پنج ظرفیتی. اهدا کننده معمول اتم اکسیژن است. Y) تعداد هماهنگی آنها شش است. تعیین غیر مستقیم کلسترول فسفر شامل رسوب مپنیم-مونیوم فسفات به روش معمول و تیتراسیون منیزیم IBO به رسوب تازه حل شده است.
ترکیبات فسفر (III) به شدت با هالوژنها تداخل می کنند و ترکیباتی با ساختار یونی در حالت بلوری ایجاد می کنند.
ترکیبات فسفر ، به عنوان مثال ، با آهن واکنش می دهند ، آلیاژی می دهند که مقدار بسیار بیشتری دارد دمای پایین ذوب شدن از آهن: ماده یوتکتیک حاوی 10٪ فسفر 2٪ در دمای 515 زیر نقطه ذوب آهن ذوب می شود. آرسنیک و برخی عناصر دیگر به روشی مشابه عمل می کنند. در سطوح صیقل داده شده ، گوه روغن باید راحت تر و با سرعت کمتری نسبت به سطوح با میکروتراش های متعدد تشکیل شود. عمل گوه زدن باعث جدا شدن سطوح و جلوگیری از سایش می شود.
ترکیبات فسفر عمدتاً بر واکنشهای رخ داده در فاز جامد تأثیر می گذارد. در طی تخریب حرارتی ، بازدارنده های شعله حاوی فسفر به اسید فسفریک (پلی) تبدیل می شوند ، که در فاز تغلیظ شده کمبود آب بستر پلیمری پیرولیز را کاتالیز می کند و منجر به کربن شدن آن می شود. با این حال ، برخی از ترکیبات فسفر ، مانند هالوژن ها ، می توانند با استفاده از مکانیزم جذب رادیکال در فاز گاز عمل کنند.
ترکیبات فسفر نقش بسزایی در زندگی گیاهان و حیوانات دارد. آنها بخشی جدایی ناپذیر از هر ارگانیسم زنده هستند. حیوانات ترکیبات فسفر را از غذاهای حیوانی و گیاهی جذب می کنند و گیاهان فسفر را از نمک های اسید فسفریک موجود در خاک استخراج می کنند. در نتیجه ، خاک به تدریج تخلیه می شود و نمی تواند غذای مورد نیاز گیاهان را تأمین کند. نیاز به کوددهی خاک با ترکیبات فسفر است.
اسید متافسفریک - اسید مونوبازیک ، ساده ترین فرمول آن HPO 3 است. ترکیب واقعی مولکولهای آن با فرمول (HPO 3) n بیان می شود ، جایی که n \u003d 3،4،5 ، و غیره. در شکل خالص آن یک توده شیشه ای است که به راحتی در آب حل می شود.
حاصل تعامل اکسید فسفر (V) با آب است:
خواص فیزیکوشیمیایی
اسید متافسفریک یک ماده شیشه ای سفید است که به راحتی در آب حل می شود و با افزودن آن ، به تدریج به اسید ارتو فسفریک تبدیل می شود:
ماده ای بسیار سمی.
ح 3 PO 4
اسید ارتو فسفریک (اسید فسفریک) - یک اسید معدنی با مقاومت متوسط \u200b\u200b، با فرمول شیمیایی H 3 PO 4 ، که در شرایط استاندارد بلورهای رطوبت بی رنگ است.
در دمای بالاتر از 213 درجه سانتیگراد ، به اسید پیرو فسفریک H 4 P 2 O 7 تبدیل می شود. بسیار محلول در آب است. معمولاً اسید ارتو فسفریک (یا به سادگی فسفریک) را محلول آبی 85٪ (مایع شربت دار بی رنگ و بدون بو) می نامند. همچنین در اتانول و سایر حلال ها محلول است.
اسید فسفریک از فسفات بدست می آید:
شما می توانید جز hyd هیدرولیز کلرید فسفر را بدست آورید:
یا با تعامل با آب اکسید فسفر (V) حاصل از احتراق فسفر با اکسیژن:
با آب ، واکنش بسیار شدید پیش می رود ، بنابراین ، اکسید فسفر (V) با یک محلول غلیظ از اسید ارتو فسفریک گرم شده تا 200 درجه سانتیگراد تصفیه می شود.
اسید فسفریک مذاب و محلول های غلیظ آن به دلیل تشکیل پیوندهای هیدروژن بین مولکولی ، گرانروی بالایی دارند.
H 3 PO 4 یک اسید تریابازیک با مقاومت متوسط \u200b\u200bاست. هنگام تعامل با یک اسید بسیار قوی ، به عنوان مثال ، پرکلریک HClO 4 ، اسید فسفریک علائم آمفوتری را نشان می دهد - نمک های فسفوریل تشکیل می شود ، به عنوان مثال [P (OH) 4] ClO4.
واکنش متمایز اسید ارتو فسفریک از سایر اسیدهای فسفریک واکنش با نیترات نقره است - رسوب زرد تشکیل می شود:
یک واکنش کیفی به یون RO 4 3− تشکیل رسوب زرد روشن فسفات مولیبدن آمونیوم است:
نمک های اسید فسفریک فسفات نامیده می شوند. اسید فسفریک نمکهای یک ، دو و سه جایگزین را تشکیل می دهد.
(سدیم دی هیدروژن فسفات)
(سدیم هیدروژن فسفات)
(فسفات سدیم)
فسفاتهای دی هیدروژن (فسفاتهای منفرد جایگزین شده) دارای واکنش اسیدی هستند ، هیدروفسفاتها (فسفاتهای جایگزین نشده) کمی قلیایی ، متوسط \u200b\u200b(فسفاتهای جایگزین شده 3 یا به سادگی فسفاتها) قلیایی هستند.
فسفات های هیدروژن معمولاً به میزان زیادی در آب حل می شوند ، تقریباً همه فسفات هیدروژن و فسفات کمی محلول هستند. نمک زدن نمک ها منجر به تغییرات زیر می شود:
فسفات ها هنگام اشتعال تجزیه نمی شوند ، استثنا فسفات آمونیوم (NH4) 3 PO 4 است.
فسفات های آلی نقش بسیار مهمی در فرآیندهای بیولوژیکی دارند. فسفاتهای قند در فتوسنتز نقش دارند. اسیدهای نوکلئیک همچنین حاوی مانده اسید فسفریک است.
کاربرد:
این ماده در لحیم کاری به عنوان شار (برای مس اکسید شده ، برای فلزات آهنی ، برای فولاد ضد زنگ) ، برای تحقیقات در زمینه زیست شناسی مولکولی استفاده می شود. همچنین برای پاک سازی زنگ زدگی از سطوح فلزی استفاده می شود. با ایجاد یک فیلم محافظ بر روی سطح تصفیه شده ، مانع از خوردگی بیشتر می شود. همچنین در ترکیبات فریون ، در فریزرهای صنعتی به عنوان چسب استفاده می شود.
به عنوان بخشی از مایعات هیدرولیک NGZh-5U و آنالوگهای خارجی آن.
اسید فسفریک به عنوان یک افزودنی غذایی ثبت شد E338... به عنوان تنظیم کننده اسیدیته در نوشیدنی های گازدار استفاده می شود.
در پرورش خز (به ویژه هنگام رشد نمک) ، از نوشیدن محلول اسید فسفریک برای جلوگیری از افزایش pH معده و ورم سنگ استفاده می شود.
اسید ارتو فسفریک قبل از پر کردن دندانها برای اچ (از بین بردن لایه آغشته شده) مینا و عاج استفاده می شود. هنگام استفاده از مواد چسبنده نسل 2 و 3 ، نیاز به اچ مینای دندان با اسید و سپس شستشو و خشک شدن است. علاوه بر زمان اضافی که برای انجام این کار صرف می شود ، این مراحل خطر بروز خطاها و عوارض مختلف را نیز به همراه دارد.
هنگام استفاده از اسید فسفریک ، کنترل درجه و عمق عاج و مین زدایی مینا دشوار است. این منجر به این واقعیت می شود که چسب اعمال شده به طور کامل (در کل عمق) توبول های عاجی باز را پر نمی کند ، و این ، به نوبه خود ، ایجاد یک لایه ترکیبی کامل را تضمین نمی کند.
علاوه بر این ، همیشه نمی توان اسید ارتو فسفریک را پس از استفاده روی عاج به طور کامل حذف کرد. این بستگی به چگونگی غلظت اسید فسفریک دارد. باقیمانده اسید فسفریک مقاومت پیوند را مختل می کند و همچنین منجر به تشکیل به اصطلاح "معدن اسید" می شود.
با ظهور مواد چسبنده نسل 4 و 5 ، از تکنیک اچ کردن (عاج - مینا) استفاده شد. سیستم های چسب نسل 6 و 7 مرحله اسید اچ جداگانه ای ندارند. بنابراین چسب ها خود اچ می شوند. اگرچه برخی از تولیدکنندگان هنوز حکاکی کوتاه مدت مینای دندان را برای افزایش چسبندگی هنگام استفاده از چسب های خود اچ توصیه می کنند.
ح 4 پ 2 ای 7
اسید دی فسفریک - یک ترکیب غیر آلی ، یک اسید تترابازیک حاوی اکسیژن با فرمول H 4 P 2 O 7 ، بلورهای بی رنگ ، محلول در آب ، هیدراتهای بلوری تشکیل می دهد.
دریافت:
انحلال اکسید فسفر در آب:
گرمایش اسید فسفریک:
واکنش اسید فسفریک با اکسید فسفر:
مشخصات فیزیکی:
اسید دی فسفریک یک ماده آمورف سفید یا کریستالی است ، بسیار رطوبت ساز است. این ماده در دو تغییر کریستالی با نقاط ذوب 54.3 و 71.5 درجه سانتیگراد وجود دارد ، این مخلوط در 61 درجه سانتیگراد ذوب می شود.
این به خوبی در آب ، اتانول ، اتر حل می شود.
این یک اسید تترابازیک با ثابت تجزیه p K 1 \u003d 1 ، p K 2 \u003d 2 ، p K 3 \u003d 6.6 ، p K 4 \u003d 9.6 است.
هیدراتهای بلوری از نوع H 4 P 2 O 7 n H 2 O را تشکیل می دهد ، جایی که n \u003d 1 ، 5 و 6
خواص شیمیایی:
هنگامی که در خلا گرم می شود ، تجزیه می شود:
وقتی محلول های آب جوشانده می شوند ، به اسید فسفریک تبدیل می شود:
با مواد قلیایی واکنش داده و نمک های طبیعی یا اسیدی ایجاد می کند:
وارد واکنشهای مبادله می شود.














