اکسیدهای اسید
اکسیدهای اسید (انیدرید) - اکسیدهایی که خاصیت اسیدی نشان می دهند و اسیدهای حاوی اکسیژن مربوطه را تشکیل می دهند. توسط فلزات معمولی و برخی از عناصر گذار شکل گرفته است. عناصر موجود در اکسیدهای اسیدی معمولاً حالت اکسیداسیون IV تا VII را نشان می دهند. آنها می توانند با برخی از اکسیدهای اساسی و آمفوتریک تعامل داشته باشند ، به عنوان مثال: با اکسید کلسیم CaO ، اکسید سدیم Na2O ، اکسید روی ZnO ، یا با اکسید آلومینیوم Al 2 O 3 (اکسید آمفوتریک).
واکنش های معمولی
اکسیدهای اسید می تواند واکنش نشان دهد با:
SO 3 + H 2 O → H 2 SO 4
2NaOH + CO 2 \u003d\u003e Na 2 CO 3 + H 2 O
Fe 2 O 3 + 3CO 2 \u003d\u003e Fe 2 (CO 3) 3
اکسیدهای اسید می توان بدست آورد از اسید مربوطه:
H 2 SiO 3 → SiO 2 + H 2 O
نمونه هایی از
- اکسید منگنز (VII) Mn 2 O 7؛
- اکسید نیتریک NO 2 ؛
- اکسید کلر Cl 2 O 5، Cl 2 O 3
همچنین ببینید
بنیاد ویکی مدیا. 2010
ببینید "اکسیدهای اسید" در دیکشنری های دیگر چیست:
اکسیدهای فلزی ترکیبات فلزات با اکسیژن هستند. بسیاری از آنها می توانند با یک یا چند مولکول آب ترکیب شده و هیدروکسید ایجاد کنند. اکثر اکسیدها اساسی هستند زیرا هیدروکسیدهای آنها مانند بازها رفتار می کنند. با این حال ، برخی ... اصطلاحات رسمی
اکسید (اکسید ، اکسید) یک ترکیب دودویی از یک عنصر شیمیایی با اکسیژن در حالت اکسیداسیون −2 است که در آن اکسیژن تنها به عنصر الکترون منفی کمتری متصل می شود. عنصر شیمیایی اکسیژن دومین عنصر الکترونیکی است ... ... ویکی پدیا
مجسمه ای تحت تأثیر باران اسیدی باران اسیدی انواع باران های هواشناسی باران ، برف ، تگرگ ، مه ، تگرگ ، که در آن کاهش pH بارندگی به دلیل آلودگی هوا با اکسیدهای اسید وجود دارد (معمولاً ... ویکی پدیا
دائرlopالمعارف جغرافیایی
اکسیدها - ترکیب یک عنصر شیمیایی با اکسیژن. توسط خواص شیمیایی همه اکسیدها به شکل نمک تشکیل می شوند (به عنوان مثال Na2O ، MgO ، Al2O3 ، SiO2 ، P2O5 ، SO3 ، Cl2O7) و غیر نمک تشکیل دهنده (به عنوان مثال CO ، N2O ، NO ، H2O). اکسیدهای نمک ساز به ... ... تقسیم می شوند راهنمای مترجم فنی
اکسیدها - شیمی ترکیبات عناصر با اکسیژن (نام قدیمی اکسیدها است) ؛ یکی از مهمترین کلاسهای شیمی. مواد O. اغلب در طول اکسیداسیون مستقیم مواد ساده و پیچیده تشکیل می شوند. سابق. در طول اکسیداسیون هیدروکربن ها ، O. تشکیل می شود ... ... دائرlopالمعارف بزرگ پلی تکنیک
- (باران اسیدی) ، مشخص شده با افزایش محتوای اسیدها (عمدتا سولفوریک) ؛ PH<4,5. Образуются при взаимодействии атмосферной влаги с транспортно промышленными выбросами (главным образом серы диоксид, а также азота … دائرlopالمعارف مدرن
ترکیبات عناصر با اکسیژن. در O. حالت اکسیداسیون اتم اکسیژن H2 است. O. شامل تمام اتصالات است. عناصر دارای اکسیژن ، به استثنای اتمهای O ، متصل به یکدیگر (پراکسیدها ، سوپراکسیدها ، ازونیدها) و کامپ. فلوئور با اکسیژن ... ... دائرlopالمعارف شیمیایی
باران اسیدی ، برف یا برف. بارش اسیدی عمدتا به دلیل انتشار اکسیدهای گوگرد و نیتروژن به اتمسفر ناشی از سوزاندن سوخت های فسیلی (زغال سنگ ، نفت و گاز طبیعی) رخ می دهد. در حال حل شدن در ... دائر Colالمعارف Collier
اکسیدها - ترکیب یک عنصر شیمیایی با اکسیژن. با توجه به خصوصیات شیمیایی آنها ، کلیه اکسیدها به نمک ساز تقسیم می شوند (به عنوان مثال Na2O ، MgO ، Al2O3 ، SiO2 ، P2O5 ، SO3 ، Cl2O7) و غیر نمک ساز (به عنوان مثال CO ، N2O ، NO ، H2O) . اکسیدهای نمک ساز ...... فرهنگ نامه دائرlopالمعارف متالورژی
که با مواد قلیایی واکنش نشان می دهند. در این حالت تشکیل نمک اتفاق می افتد. اما آنها با اسیدها برهم کنش ندارند.
اکسیدهای اسیدی عمدتا توسط غیر فلزات تشکیل می شوند. به عنوان مثال ، این گروه شامل گوگرد ، فسفر و کلر است. علاوه بر این ، می توان موادی با همان خصوصیات را از عناصر به اصطلاح انتقالی با ظرفیت پنج تا هفت تشکیل داد.
اکسیدهای اسیدی هنگام تعامل با آب می توانند اسید تشکیل دهند. هر اسید معدنی یک اکسید مربوطه دارد. به عنوان مثال ، اکسیدهای گوگرد اسیدهای سولفات و سولفیت و اسیدهای فسفر - ارتو و متافسفات تشکیل می دهند.
اکسیدهای اسیدی و روش های تهیه آنها
چندین روش اصلی برای بدست آوردن اکسیدها با وجود دارد
متداول ترین روش اکسیداسیون اتم های غیر فلزی با اکسیژن است. به عنوان مثال ، وقتی فسفر با اکسیژن تعامل دارد ، اکسید فسفر بدست می آید. البته این روش همیشه امکان پذیر نیست.
واکنش نسبتاً رایج دیگر تفت دادن سولفید اکسیژن است. علاوه بر این ، اکسیدها با واکنش نمک های خاص با اسیدها بدست می آیند.
گاهی اوقات در آزمایشگاه ها از تکنیک کمی متفاوت استفاده می شود. در طول واکنش ، آب از اسید مربوطه گرفته می شود - یک فرآیند کم آبی اتفاق می افتد. به هر حال ، به همین دلیل است که اکسیدهای اسیدی نیز با نام دیگری شناخته می شوند - انیدریدهای اسید.
خواص شیمیایی اکسیدهای اسید
همانطور که قبلاً ذکر شد ، انیدریدها می توانند با اکسیدهای اساسی یا مواد قلیایی تداخل کنند. در نتیجه این واکنش ، نمکی از اسید مربوطه و در واکنش با یک باز ، آب نیز تشکیل می شود. این فرآیند است که خصوصیات اسیدی اساسی اکسیدها را مشخص می کند. علاوه بر این ، انیدریدها با اسیدها برهم کنش ندارند.
خاصیت دیگر این مواد توانایی واکنش با بازها و اکسیدهای آمفوتریک است. نمکها نیز در نتیجه این فرآیند تشکیل می شوند.
علاوه بر این ، برخی از انیدریدها با آب واکنش می دهند. در نتیجه این فرآیند ، تشکیل اسید مربوطه مشاهده می شود. به این ترتیب برای مثال در شرایط آزمایشگاهی اسید سولفوریک بدست می آید.
رایج ترین انیدریدها: شرح مختصری
رایج ترین و شناخته شده ترین اکسید اسیدی دی اکسید کربن است. در شرایط عادی ، این ماده یک گاز بی رنگ ، بدون بو ، اما با طعم کمی ترش است.
به هر حال ، در فشار اتمسفر ، دی اکسید کربن می تواند به صورت گازی یا حالت جامد وجود داشته باشد. برای تبدیل انیدرید کربن به مایع ، افزایش فشار لازم است. این خاصیت است که برای ذخیره یک ماده استفاده می شود.
دی اکسید کربن به گروه گازهای گلخانه ای تعلق دارد ، زیرا با حفظ گرما در جو ، گازهای ساطع شده توسط زمین را به طور فعال جذب می کند. با این حال ، این ماده برای زندگی موجودات بسیار مهم است. دی اکسید کربن در جو سیاره ما یافت می شود. علاوه بر این ، توسط گیاهان در فرآیند های فتوسنتز استفاده می شود.
انیدرید سولفوریک یا تری اکسید گوگرد یکی دیگر از نمایندگان این گروه از مواد است. در شرایط عادی ، مایعی بی رنگ ، بسیار فرار و بوی نامطبوع و خفه کننده ای است. این اکسید در صنایع شیمیایی بسیار مهم است ، زیرا عمده اسید سولفوریک از آن تولید می شود.
اکسید سیلیکون ماده ای کاملاً شناخته شده دیگر است که در حالت طبیعی خود کریستال است. به هر حال ، شن و ماسه از این ترکیب تشکیل شده است. در صورت گرم شدن ، قادر به ذوب شدن و جامد شدن است. از این خاصیت در تولید شیشه استفاده می شود. علاوه بر این ، این ماده عملا جریان الکتریکی را هدایت نمی کند ، بنابراین من از آن به عنوان دی الکتریک استفاده می کنم.
اکسیدها
یکی) تعریف: اکسیدها مواد پیچیده ای هستند که از 2 عنصر تشکیل شده اند ، یکی از آنها اکسیژن در حالت اکسیداسیون –2 است.
2) طبقه بندی. اکسیدها به اکسیدهای اسیدی ، اساسی و آمفوتریک تقسیم می شوند.
الف) اکسیدها اسیدی نامیده می شوند که مربوط به اسیدها هستند.
مثالها: SO 3 - H 2 SO 4 ، CO 2 - H 2 CO 3 ، N 2 O 5 - HNO 3 ، Cl 2 O 7 - HClO 4 ، CrO 3 - H 2 CrO 4 ، Mn 2 O 7 - HMnO 4
ب) اکسیدهای اساسی نامیده می شوند که با پایه مطابقت دارند. مثالها: Na 2 O - NaOH ، CaO - Ca (OH) 2 ، MnO - Mn (OH) 2 ، CrO - Cr (OH) 2.
ج) اکسیدهای آمفوتریک آنهایی هستند که می توانند خواص اسیدی و اساسی را نشان دهند. مثالها: Al 2 O 3 ، Cr 2 O 3 ، ZnO ، BeO. اکسیدهای آمفوتریک مربوط به هیدروکسیدهای آمفوتریک هستند
4) روشهای تولید اکسیدها.
الف) احتراق مواد ساده:
4P + 5O 2 → 2P 2 O 5 4Al + 3O 2 → 2Al 2 O 3
ب) احتراق و شلیک مواد پیچیده:
CH 4 + 2O 2 → CO 2 + 2H 2 O 2ZnS + 3O 2 → 2ZnO + 2SO 2
ج) تجزیه مواد پیچیده:
کربناتها (نامحلول) BaCO 3 BaO + CO 2
- پایه های 2Fe (OH) 3 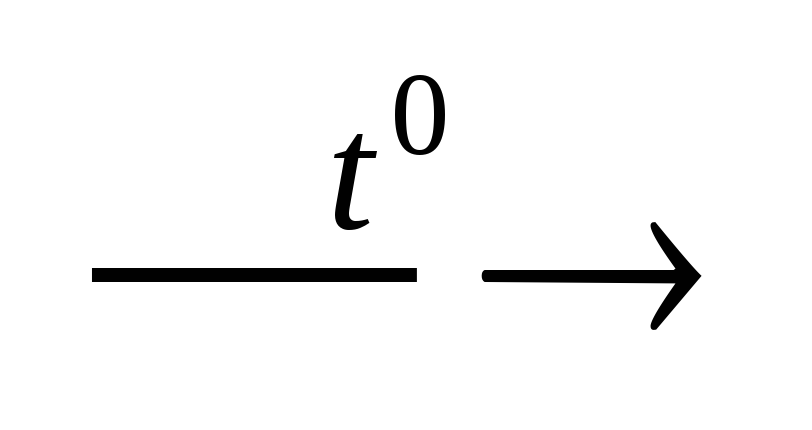 اسیدهای Fe 2 O 3 + 3H 2 O
اسیدهای Fe 2 O 3 + 3H 2 O
پنج) خواص شیمیایی اکسیدهای اساسی:
الف) تعامل با آب. قانون: اگر محصول واکنش در آب محلول باشد ، اکسید با آب ارتباط برقرار می کند (و بالعکس)
Na 2 O + H 2 O 2NaOH
FeO + H 2 O واکنش نشان نمی دهد ، زیرا Fe (OH) 2 در آب نامحلول است.
ب) برهم کنش با اسیدها. وقتی اکسیدهای اساسی با اسیدها واکنش می دهند ، نمک و آب تشکیل می شود.
CuO + H 2 SO 4 CuSO 4 + H 2 O (نیاز به حرارت دارد)
به موارد زیر توجه کنید:
- اسید سیلیسیک با اکسیدهای اساسی واکنش نمی دهد ("جامد" با "جامد" واکنش نمی دهد)
ج) برهم کنش با اکسیدهای اسیدی. این واکنشها هنگام گرم شدن ، در هنگام تشکیل نمک ایجاد می شوند:
CaO + CO 2 \u003d CaCO 3
توجه: معادلات واکنش در بندهای 6b و 6c اثبات خصوصیات اساسی اکسیدها است
د) برهم کنش با اکسیدهای آمفوتریک.
Na 2 O + Al 2 O 3 2 NaAlO 2 (در صورت گرم شدن)
Na 2 O + ZnONa 2 ZnO 2 (وقتی گرم می شود)
6) خواص شیمیایی اکسیدهای اسیدی:
الف) تعامل با آب. قانون: اگر محصول واکنش در آب محلول باشد ، اکسید با آب ارتباط برقرار می کند (اگر محصول واکنش در آب نامحلول باشد ، اکسید با آب ارتباط برقرار نمی کند)
کلیه اکسیدهای اسید به استثنای SiO 2 با آب واکنش نشان می دهند.
P 2 O 5 + 3H 2 O 2H 3 PO 4 (در صورت گرم شدن)
واکنش SiO 2 + H 2 O go انجام نمی شود ، زیرا H 2 SiO 3 نامحلول در آب است
ب) تعامل با اکسیدهای اساسی و آمفوتریک (به قسمت 6.c مراجعه کنید)
د) تعامل با بازها. قانون: اکسیدهای اسیدی با مواد قلیایی برهم کنش ایجاد نمک و آب می کنند. مثال:
2NaOH + CO 2 Na 2 CO 3 + H 2 O
8) خواص شیمیایی اکسیدهای آمفوتریک.
الف) اکسیدهای آمفوتریک با آب واکنش نمی دهند
ب) اکسیدهای آمفوتریک خصوصیات اساسی را در واکنش با اسیدها نشان می دهند ، به عنوان مثال واکنش ها همانند اکسیدهای اساسی پیش می روند
مثال: Al 2 O 3 + 6HCl 2AlCl 3 + 3H 2 O
ج) تعامل با مواد قلیایی. بسته به شرایط ، واکنشها به روشهای مختلف انجام می شود:
Al 2 O 3 + 2NaOH + 3H 2 O 2Na (در محلول)
Al 2 O 3 + 2NaOH N2NaAlO 2 + H 2 O (در صورت گرم شدن)
د) تعامل با اکسیدهای اساسی (نگاه کنید به شماره 6d)
ه) هنگام تعامل با اکسیدهای اسیدی ، اکسیدهای آمفوتریک خصوصیات اساسی را نشان می دهند.
مثال: Al 2 O 3 + P 2 O 5 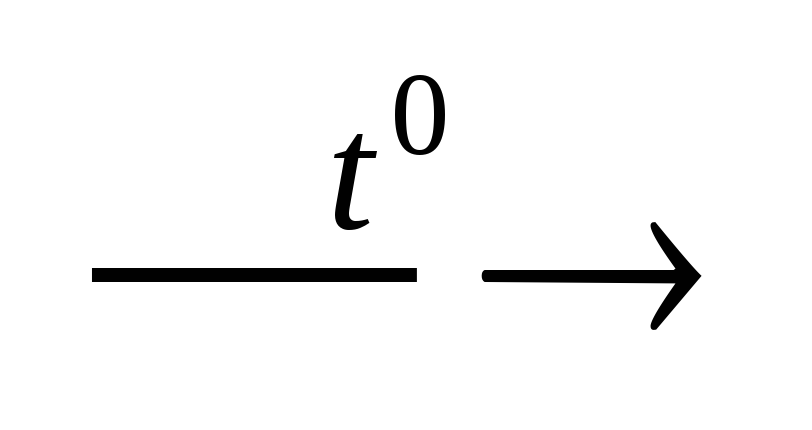 2AlPO 4
2AlPO 4













